
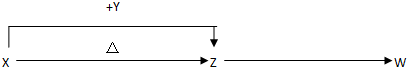
分析 X、Y、Z的焰色反应均为黄色,说明三者均为钠元素的化合物.X含有四种元素,在加热条件下能生成Z,可推知,X为NaHCO3,Y为NaOH,Z为Na2CO3,Z得到W为无色无味的气体,应是与酸反应生成的CO2.
(1)分析可知W为二氧化碳;
(2)氢氧化钠与碳酸氢钠反应生成碳酸钠与水;
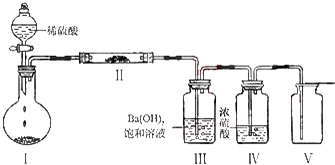
(3)①NaHCO3含有的四种元素之间(二种、三种或四种)可组成多种化合物,根据装置Ⅲ中Ba(OH)2饱和溶液产生白色沉淀,且图示中装置I、Ⅱ中的物质均为固体,推测装置I中的物质为NaHCO3或Na2CO3固体,因为装置Ⅴ中收集到一种无色气体,说明装置I中产生的CO2与装置Ⅱ中的物质反应生成了另一种无色气体,进而推测出装置Ⅱ中的物质为Na2O2,装置Ⅴ中收集的气体是O2;
②装置Ⅴ中收集的气体是O2,O2的制取也可以用H2O2 在二氧化锰作催化剂条件下分解制得,I为发生装置,Ⅳ进行干燥,Ⅴ进行收集;
解答 解:X、Y、Z的焰色反应均为黄色,说明三者均为钠元素的化合物.X含有四种元素,在加热条件下能生成Z,可推知,X为NaHCO3,Y为NaOH,Z为Na2CO3,Z得到W为无色无味的气体,应是与酸反应生成的CO2,
(1)上述分析可知W为CO2,故答案为:CO2;
(2)氢氧化钠与碳酸氢钠反应生成碳酸钠与水,反应离子方程式为:HCO3-+OH-=CO32-+H2O,
故答案为:HCO3-+OH-=CO32-+H2O;
(3)NaHCO3含有的四种元素之间(二种、三种或四种)可组成多种化合物,根据装置Ⅲ中Ba(OH)2饱和溶液产生白色沉淀,且图示中装置I、Ⅱ中的物质均为固体,推测装置I中的物质为NaHCO3或Na2CO3固体,因为装置Ⅴ中收集到一种无色气体,说明装置I中产生的CO2与装置Ⅱ中的物质反应生成了另一种无色气体,进而推测出装置Ⅱ中的物质为Na2O2,装置Ⅴ中收集的气体是O2.
①装置Ⅰ中反应的化学方程式:Na2CO3+H2SO4=Na2SO4+CO2↑+H2O或2NaHCO3+H2SO4=Na2SO4+2CO2↑+2H2O,装置Ⅱ中物质的化学式为Na2O2,
故答案为:Na2CO3+H2SO4=Na2SO4+CO2↑+H2O或2NaHCO3+H2SO4=Na2SO4+2CO2↑+2H2O;Na2O2;
②O2的制取也可以用2H2O2 $\frac{\underline{\;MnO_{2}\;}}{\;}$2H2O+O2↑制备,I为发生装置,Ⅳ进行干燥,Ⅴ进行收集,
故答案为:H2O2;Ⅰ、Ⅳ、Ⅴ;
点评 本题考查无机物推断,涉及钠元素化合物的相互转化,要求学生对元素化合的知识非常熟练,把握常见气体的制备方法,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:多选题
| A. | KOH溶液与AlCl3溶液 | B. | AlCl3溶液与氨水 | ||
| C. | NaAlO2溶液与盐酸 | D. | NaHCO3溶液与盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤ | B. | ①②⑦ | C. | ②③⑤⑥ | D. | ①③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
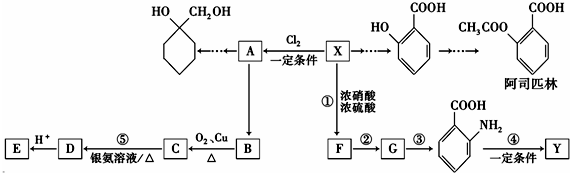
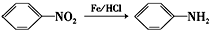 (苯胺,易被氧化)
(苯胺,易被氧化)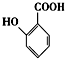 的名称为邻羟基苯甲酸,G中官能团名称为硝基、羧基;
的名称为邻羟基苯甲酸,G中官能团名称为硝基、羧基; ;
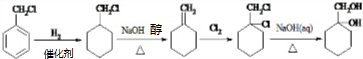
; $\stackrel{一定条件下}{→}$
$\stackrel{一定条件下}{→}$ +(n-1)H2O;
+(n-1)H2O;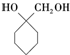 的合成路线(无机试剂任用).合成路线流程图示例如下:
的合成路线(无机试剂任用).合成路线流程图示例如下: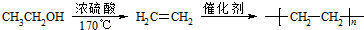
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | IA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ||||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ||||
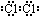 ,由②、④两种元素的原子按1:1组成化合物的电子式为
,由②、④两种元素的原子按1:1组成化合物的电子式为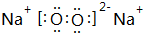 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1MgCl2溶液中含有的Mg2+数目一定小于0.1NA | |
| B. | 标准状况下,11.2 L CCl4中含有的分子数目为0.5NA | |
| C. | 4.6g由NO2和N2O4组成的混合物中含有氧原子的数目为0.2 NA | |
| D. | 1 mol CH5+中含有的电子数目为11NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com