
| A. | ①②③④⑤ | B. | ①②⑦ | C. | ②③⑤⑥ | D. | ①③⑤ |
分析 ①氦气为单原子分子;
②NO2和N2O4的最简式均为NO2;
③标准状况下,5.6LCO2的物质的量为0.25mol,而二氧化碳与过氧化钠反应时,1mol二氧化碳反应时,反应转移1mol电子;
④溶液体积不明确;
⑤氯气和水的反应为可可逆反应,不能进行彻底;
⑥标准状况下,CCl4为液态;
⑦Cl2与铁反应后氯元素变为-1价.
解答 解:①氦气为单原子分子,故1mol氦气中含NA个原子,故①正确;
②NO2和N2O4的最简式均为NO2,故46g混合物中含NO2的物质的量为n=$\frac{46g}{46g/mol}$=1mol,则含3mol原子即3NA个,故②正确;
③标准状况下,5.6LCO2的物质的量为0.25mol,而二氧化碳与过氧化钠反应时,1mol二氧化碳反应时,反应转移1mol电子,故0.25mol二氧化碳反应时,反应转移0.25mol电子即0.25NA个,故③错误;
④溶液体积不明确,故溶液中的钠离子的个数无法计算,故④错误;
⑤氯气和水的反应为可可逆反应,不能进行彻底,故反应转移的电子数小于0.1NA个,故⑤错误;
⑥标准状况下,CCl4为液态,故不能根据气体摩尔体积来计算其物质的量,故⑥错误;
⑦Cl2与铁反应后氯元素变为-1价,故0.1mol氯气反应后转移0.2mol电子即0.2NA个,故⑦正确.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


科目:高中化学 来源: 题型:填空题
| 共价键 | N≡N | H-H | N-H |
| 键能(kJ/mol) | 946 | 436 | 390.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
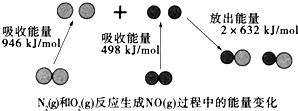
| A. | 该反应的热化学方程式为:N2(g)+O2(g)═2NO(g)△H=+180kJ•mol-1 | |
| B. | 1mol N2(l)和NA个O2(l)反应生成2mol NO(g)时,吸收的能量为180kJ | |
| C. | 1mol N2(g)和1mol O2(g)具有的总能量小于2mol NO(g)具有的总能量 | |
| D. | 通常情况下,N2(g)和O2(g)混合不能直接生成NO(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ② | C. | ②③ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaA的溶液呈碱性 | B. | pH=2的HA溶液稀释100倍后pH=3.5 | ||
| C. | 0.01 mol•Lˉ1HA溶液的pH=4 | D. | HA溶液跟锌反应,放出H2很慢 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有①④ | B. | 只有②③ | C. | ①②③ | D. | ①②③④都不能 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质的量就是物质的质量 | |
| B. | 2mol H2O 可以说为水分子的摩尔数为2mol | |
| C. | 物质的量是以摩尔为单位计量粒子数目的物理量 | |
| D. | 物质的量和摩尔都是含有一定数目粒子的集体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com