
| A. | NaA的溶液呈碱性 | B. | pH=2的HA溶液稀释100倍后pH=3.5 | ||
| C. | 0.01 mol•Lˉ1HA溶液的pH=4 | D. | HA溶液跟锌反应,放出H2很慢 |
分析 要证明一元酸HR为弱酸,可证明存在电离平衡、不能完全电离或从对应的强碱盐溶液呈碱性的角度,以此解答该题.
解答 解:A.常温下,NaA的溶液呈碱性,说明NaA为强碱弱酸盐,水解呈碱性,可证明HA为弱酸,故A不选;
B.常温下,将pH=2的HA溶液稀释100倍,测得pH=3.5,说明加水稀释促进电离,如为强酸,稀释后pH=4,所以可证明为弱酸,故B不选;
C.常温下,测得0.01 mol/LHA溶液的pH=4,说明HA没有完全电离,可证明HA为弱酸,故C不选;
D.HA溶液跟锌反应,生成氢气的快慢与溶液的浓度有关,不能根据放出H2很慢,判断为弱酸,如果是强酸浓度很小生成氢气的速率也很小,故D选.
故选D.
点评 本题考查实验方案的评价,侧重于弱酸的实验角度的探究,注意把握实验原理和角度,学习中注意相关基础知识的积累,题目难度不大.


 学习实践园地系列答案
学习实践园地系列答案科目:高中化学 来源: 题型:选择题
| A. | H2SO4、HClO、BaCO3是电解质 | |
| B. | 生石灰与水混合发生化学、物理变化 | |
| C. | 丁达尔效应可以区分溶液与胶体 | |
| D. | 光导纤维中所用材料为晶体硅 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
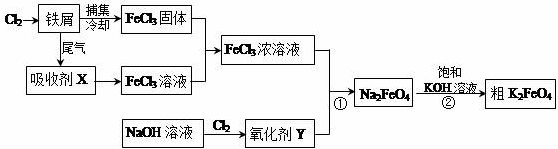
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤ | B. | ①②⑦ | C. | ②③⑤⑥ | D. | ①③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 若Ⅰ达平衡时,A、B、C各增加1mol,则A的转化率将一定增大 | |
| B. | 若向Ⅰ平衡体系中再加入1molA和3molB,C的体积分数若大于x,可断定n>3 | |
| C. | 若Ⅱ体系起始物质的量当满足9a+c=3b,则可判断n=3 | |
| D. | 若n=2,则Ⅱ体系起始物质的量应满足1<b<3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 清晨的阳光穿过茂密的林木枝叶所产生的美丽景象(美丽的光线) | |
| B. | 静电除尘 | |
| C. | 在海水与河水交界处,易形成三角洲 | |
| D. | 向FeCl3溶液中加入NaOH溶液,会出现红褐色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com