
| A. | k=2 | B. | k=$\frac{2}{3}$ | C. | 2≥k≥3 | D. | 2>k>$\frac{2}{3}$ |
分析 容器中压强接近为零,容器内没有氧气剩余,剩余固体为Na2CO3和NaOH,可根据反应的总化学方程式判断原混合物中甲烷、氧气、过氧化钠的物质的量之比.
解答 解:容器中压强接近为零,容器内没有氧气剩余,剩余固体为Na2CO3和NaOH,
根据甲烷的组成可知生成的Na2CO3和NaOH物质的量之比为1:4,则反应的总化学方程式可写为:2CH4+O2+6Na2O2=2Na2CO3+8NaOH,
根据方程式可知:原O2、CH4物质的量之比为1:2,
故选A.
点评 本题考查混合物的计算,难度中等,判断剩余固体为Na2CO3和NaOH,利用甲烷的组成确定二者物质的量之比,利用总方程式解答可以省去中间反应复杂计算的过程.


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:选择题
| A. | Cl2的摩尔质量为71 | |
| B. | 12C、13C、14C是碳元素的三种核素,互称为同位素 | |
| C. | 0.012kg12C中所含的原子数称为阿伏加德罗常数 | |
| D. | 卢瑟福根据α粒子散射实验,提出了带核的原子结构模型 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
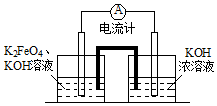 2014年我国的冶金行业深受经济危机的冲击,尤其是Al、Fe的价格下滑幅度很大.请完成下面问题:
2014年我国的冶金行业深受经济危机的冲击,尤其是Al、Fe的价格下滑幅度很大.请完成下面问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向小苏打溶液中加入少量石灰水:HCO3-+OH-+Ca2+=CaCO3↓+2H2O | |
| B. | 向烧碱溶液中加入铝片:2Al+2OH-+2H2O=2AlO2-+3H2↑ | |
| C. | 向HI溶液中加入Fe(OH)3固体:Fe(OH)3+3H+=Fe3++3H2O | |
| D. | 向MgSO4溶液中加入Ba(OH)2溶液:Ba2++SO42--=BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应的氧化剂是 ClO- | |
| B. | 消耗 l mol 还原剂,转移电子 3 mol | |
| C. | 氧化剂与还原剂的物质的量之比为 2:3 | |
| D. | 反应后溶液的酸性明显增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
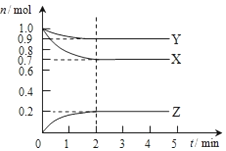 某温度时,在2L容器中X、Y、Z三种气态物质的物质的量(n)随时间(t)变化的曲线如图所示,由图中数据分析:
某温度时,在2L容器中X、Y、Z三种气态物质的物质的量(n)随时间(t)变化的曲线如图所示,由图中数据分析:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液是呈电中性的,胶体是带电的 | |
| B. | 通电时,溶液中的溶质粒子分别向两极移动,胶体中的分散质粒子向某一极移动 | |
| C. | 胶体的分散质可以通过过滤从分散剂中分离出来 | |
| D. | 胶体与其他分散系最本质的区别是:胶体粒子直径介于(1---100 )nm之间 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com