
| A. | O2是氧化剂,S2O32-、Fe2+ 是还原剂 | |
| B. | 当有1 mol Fe3O4生成时共转移的电子为4mol | |
| C. | 若有3mol Fe2+ 参加反应,则被Fe2+还原的O2为1mol | |
| D. | 若有2mol Fe2+ 被氧化,则被Fe2+还原的O2为0.5mol |
分析 3Fe2++2S2O32-+O2+4OH-=Fe3O4+S4O62-+2H2O中,Fe元素的化合价由+2价升高为+3价,S元素的化合价升高,只有氧气中O元素的化合价降低,该反应中转移4e-,以此来解答.
解答 解:A.Fe、S元素的化合价升高,O元素的化合价降低,则O2是氧化剂,S2O32-和Fe2+是还原剂,故A正确;
B.每生成1molFe3O4,由O元素的化合价变化可知,转移电子数为1mol×2×(2-0)=4mol,故B正确;
C.若有3mol Fe2+ 参加反应,由电子守恒可知,则被Fe2+还原的O2为$\frac{2mol×(3-2)}{2×(2-0)}$=0.5mol,故C错误;
D.若有2molFe2+被氧化,由电子守恒可知,则被Fe2+还原的O2为$\frac{2mol×(3-2)}{2×(2-0)}$=0.5mol,故D正确;
故选C.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重电子转移及电子守恒的考查,注意选项C、D为解答的易错点,题目难度不大.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胶体区别于其它分散系的本质特征是具有丁达尔现象 | |
| B. | 碱性氧化物一定是金属氧化物,金属氧化物不一定是碱性氧化物 | |
| C. | 根据化合物中含氢数目的多少,把化合物分为一元酸、二元酸、三元酸等 | |
| D. | 强电解质溶液的导电能力一定强于弱电解质溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.5×10-4m mol | B. | 5.0×10-4m mol | C. | 7.5×10-4m mol | D. | 1×10-3m mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | MgO和Al2O3在工业上用于制作耐高温材料,也可用于电解法冶炼Mg、Al | |
| B. | 水泥冶金厂常用高压电除去工厂烟尘,利用了胶体的性质 | |
| C. | 高空臭氧层吸收太阳紫外线,保护地球生物;反应3O2═2O3有单质参加,属于氧化还原反应 | |
| D. | 向水中加入明矾进行杀菌消毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将二氧化碳通过过氧化钠使其增重ag 反应中转移电子数为 $\frac{a{N}_{A}}{14}$ | |
| B. | 1mol Cl2 通入水中,则n(HClO)+n(Cl-)+n(ClO-)=2NA | |
| C. | 常温常压下,3克含甲醛的冰醋酸中含有的原子总数为0.4NA | |
| D. | 2.24升的甲烷中含有的C-H键数为0.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
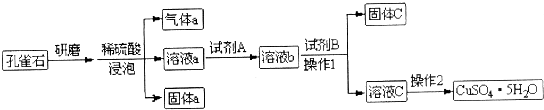
| A. | 研磨孔雀石的目的是增大固体表面积,从而加快反应速率 | |
| B. | 试剂A目的是将溶液中Fe2+转化为Fe3+,可选用双氧水作氧化剂 | |
| C. | 试剂B目的是作pH调节剂,使Fe3+转化为沉淀 | |
| D. | 试剂B可以选择NaOH或氨水等碱性试剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com