

分析 C可用电解法生成,且与浓硝酸物明显现象,应为Al,则A为Al2O3,E为O2,D为黄绿色气体,应为Cl2,则B为MnO2,由转化关系可知M为AlCl3,G为Al(OH)3,N为NaAlO2,X为HCl,结合对应物质的性质以及题目要求解答该题.
解答 解:(1)A为Al2O3,为离子化合物,含有离子键,故答案为:离子键;
(2)M为AlCl3,与过量氨水反应生成Al(OH)3,Al(OH)3不溶于弱碱,反应的离子方程式为Al3++3NH3•H2O=Al(OH)3↓+3NH4+,
故答案为:Al3++3NH3•H2O=Al(OH)3↓+3NH4+;
(3)向溶液NaAlO2中先通入过量二氧化碳,可生成氢氧化铝和碳酸氢钠,发生反应的方程式为NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3,再加入过量稀盐酸,发生Al(OH)3+3HCl=AlCl3+3H2O,NHCO3+HCl=CO2↑+H2O+NaCl,
故答案为:有白色沉淀生成,加HCl后沉淀全部溶解,同时产生气泡;NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3、Al(OH)3+3HCl=AlCl3+3H2O、NHCO3+HCl=CO2↑+H2O+NaCl;
(4)B为MnO2,与浓盐酸在加热条件下生成氯化锰、氯气和水,反应的方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,
故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
点评 本题综合考查无机物的推断,为高考常见题型,侧重于学生的分析能力以及元素化合物知识的综合理解和运用的考查,注意相关基础知识的积累,把握物质的性质以及反应的现象,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 加 Ba(OH)2溶液,产生大量沉淀 | |
| B. | 加Ba(OH)2溶液,产生大量沉淀;再加盐酸,沉淀溶解,同时产生气体 | |
| C. | 加Ba(OH)2溶液,产生大量沉淀;再加盐酸,沉淀溶解,同时产生无色无味能使澄清石灰水变浑浊的气体 | |
| D. | 加BaCl2溶液,没有沉淀,再加NaOH溶液,产生大量沉淀;最后加盐酸,沉淀溶解,同时产生无色无味能使澄清石灰水变浑浊的气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
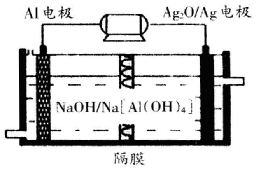 碳、氮和铝的单质及其化合物在工农业生产和生活中有重要用途.
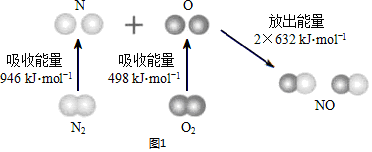
碳、氮和铝的单质及其化合物在工农业生产和生活中有重要用途. | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.00 | 0.68 | 0.50 | 0.50 | 0.60 | 0.60 |
| N2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
| CO2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 液氨汽化时要吸收大量的热,常用作制冷剂 | |
| B. | 压减燃煤、严格控车、调整产业是治理雾霾的有效措施 | |
| C. | 手机外壳上贴的碳纤维外膜是一种新型的无机非金属材料 | |
| D. | 纯碱可用于生产普通玻璃,也可用来治疗胃酸过多的病症 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
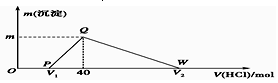
| A. | 原合金质量为0.92 g | |
| B. | 图中V2为60 | |
| C. | 整个滴定过程中Na+的浓度保持不变 | |
| D. | OP段发生的反应为:NaOH+HCl═NaCl+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | O2是氧化剂,S2O32-、Fe2+ 是还原剂 | |
| B. | 当有1 mol Fe3O4生成时共转移的电子为4mol | |
| C. | 若有3mol Fe2+ 参加反应,则被Fe2+还原的O2为1mol | |
| D. | 若有2mol Fe2+ 被氧化,则被Fe2+还原的O2为0.5mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2 molH2(g)和1molO2(g)的总能量小于2mol H2O (l)的能量 | |
| B. | 1 mol H2O (g)分解成H2(g)和O2 (g),吸收241.8kJ能量 | |
| C. | 1mol H2O (l)变成1mo1 H2O (g),吸收88 kJ能量 | |
| D. | 等质量的H2O (g)比H2O(l)所含能量低 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com