
【题目】乙醇是一种重要的化工原料和燃料,常见合成乙醇的途径如下:
(1)乙烯气相直接水合法:C2H4(g)+H2O(g)=C2H5OH(g) ΔH1=akJ·mol-1
已知:C2H4(g)+3O2(g)=2CO2(g)+2H2O(g) ΔH2=-1323.0kJ·mol-1
C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g) ΔH3=-1278.5kJ·mol-1,则a=__。
(2)工业上常采用CO2和H2为原料合成乙醇,某实验小组将CO2(g)和H2(g)按1:3的比例置于一恒容密闭容器中发生反应:2CO2(g)+6H2(g)![]() C2H5OH(g)+3H2O(g) ΔH=bkJ·mol-1。在相同的时间内,容器中CO2的浓度随温度T的变化如图1所示,上述反应的pK(pK=-lgK,K表示反应平衡常数)随温度T的变化如图2所示。
C2H5OH(g)+3H2O(g) ΔH=bkJ·mol-1。在相同的时间内,容器中CO2的浓度随温度T的变化如图1所示,上述反应的pK(pK=-lgK,K表示反应平衡常数)随温度T的变化如图2所示。
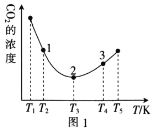
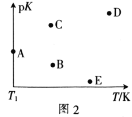
①由图1可知,b=__(填“![]() ”“
”“![]() ”或“<”)0。
”或“<”)0。
②在T1~T2及T4~T5两个温度区间内,容器中CO2(g)的浓度呈现如图1所示的变化趋势,其原因是___。
③图1中点1、2、3对应的逆反应速率v1、v2、v3中最大的是___(填“v1”“v2”或“v3”);要进一步提高H2(g)的转化率,可采取的措施有___(任答一条)。
④图2中当温度为T1时,pK的值对应A点,则B、C、D、E四点中表示错误的是__。
⑤乙烯气相直接水合法过程中会发生乙醇的异构化反应:C2H5OH(g)![]() CH3OCH3(g) ΔH=+50.7kJ·mol-1,该反应的速率方程可表示为v正=k正c(C2H5OH)和v逆=k逆c(CH3OCH3),k正和k逆只与温度有关。该反应的活化能Ea(正)__(填“
CH3OCH3(g) ΔH=+50.7kJ·mol-1,该反应的速率方程可表示为v正=k正c(C2H5OH)和v逆=k逆c(CH3OCH3),k正和k逆只与温度有关。该反应的活化能Ea(正)__(填“![]() ”“
”“![]() ”或“<”) Ea(逆),已知:T℃时,k正=0.006s-1,k逆=0.002s-1,该温度下向某恒容密闭容器中充入1.5mol乙醇和4mol甲醚,此时反应__(填“正向”或“逆向”)进行。
”或“<”) Ea(逆),已知:T℃时,k正=0.006s-1,k逆=0.002s-1,该温度下向某恒容密闭容器中充入1.5mol乙醇和4mol甲醚,此时反应__(填“正向”或“逆向”)进行。
【答案】-44.5 < T1~T2区间,化学反应未达到平衡,反应正向进行,温度越高,反应速率越快,所以CO2的浓度随温度的升高而减小;T3以后曲线上对应的点均达到平衡,该反应的正反应是放热反应,温度升高,平衡逆向移动,CO2的浓度随温度的升高而增大 v3 提高CO2的浓度或适当降温或及时移出生成物 BE > 正向
【解析】
(1) 已知:I:C2H4(g)+3O2(g)=2CO2(g)+2H2O(g) ΔH2=-1323.0kJ·mol-1
II:C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g) ΔH3=-1278.5kJ·mol-1;
根据盖斯定律I-II可得C2H4(g)+H2O(g)=C2H5OH(g) ΔH1=ΔH2-ΔH3=(-1323.0kJ·mol-1)-(-1278.5kJ·mol-1)=-44.5 kJ·mol-1;
(2)①据图可知当温度低于T3时随温度上升,CO2的浓度下降,而温度高于T3时随温度上升,CO2的浓度上降,说明相同时间内温度低于T3时反应没有达到平衡,而温度高于T3时,该时段内反应达到平衡,且温度上升平衡左移CO2的浓度上降,所以正反应为放热反应,所以b<0;
②T1~T2区间,化学反应未达到平衡,反应正向进行,温度越高,反应速率越快,所以CO2的浓度随温度的升高而减小;T3以后曲线上对应的点均达到平衡,该反应的正反应是放热反应,温度升高,平衡逆向移动,CO2的浓度随温度的升高而增大;
③温度越高反应速率越快,所以逆反应速率最大的是v3;提高CO2的浓度或及时移出生成物,平衡都可以正向移动增大氢气的转化率,该反应正反为放热反应,适当降低温度也可以提高提高氢气的转化率;
④该反应为放热反应,所以温度越高平衡常数越小,则pK越大,所以BE二点表示错误;
⑤该反应焓变大于0,焓变=正反应活化能-逆反应活化能>0,所以Ea(正)> Ea(逆);反应达到平衡时正逆反应速率相等,即v正=k正c(C2H5OH)=v逆=k逆c(CH3OCH3),所以有![]() ,T℃时,k正=0.006s-1,k逆=0.002s-1,所以该温度下平衡常数K=
,T℃时,k正=0.006s-1,k逆=0.002s-1,所以该温度下平衡常数K=![]() =3,该反应前后气体系数之和相等,所以可以用物质的量代替浓度计算浓度商和平衡常数, 所以该温度下向某恒容密闭容器中充入1.5mol乙醇和4mol甲醚时,浓度商Q=
=3,该反应前后气体系数之和相等,所以可以用物质的量代替浓度计算浓度商和平衡常数, 所以该温度下向某恒容密闭容器中充入1.5mol乙醇和4mol甲醚时,浓度商Q=![]() <3,所以此时反应正向移动。
<3,所以此时反应正向移动。


 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案科目:高中化学 来源: 题型:
【题目】CuS、Cu2S用于处理酸性废水中的Cr2O72-反应如下。反应I:CuS+Cr2O72-+H+→Cu2++SO42-+Cr3++H2O(未配平) 反应Ⅱ:Cu2S+Cr2O72-+H+→Cu2++SO42-+Cr3++H2O(未配平) 下列有关说法正确的是
A. 反应I和Ⅱ中各有2种元素的化合价发生变化
B. 处理1molCr2O72-时反应I、Ⅱ中消耗H+的物质的量相等
C. 反应Ⅱ中还原剂与氧化剂的物质的量之比为3:5
D. 质量相同时,Cu2S能去除更多的Cr2O72-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纪录片《我在故宫修文物》表现了文物修复者穿越古今与百年之前的人进行对话的职业体验,让我们领略到历史与文化的传承。下列文物修复和保护的过程中涉及化学变化的是( )
A | B | C | D |
|
|
|
|
银器用除锈剂除锈 | 变形的金属香炉复原 | 古画水洗除尘 | 木器表面擦拭烫蜡 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜碘杂化团簇具有优异的光学性能,可用于制备发光二极管、发光墨水、生物成像仪器等。一种铜碘杂化团簇的合成路线如图:
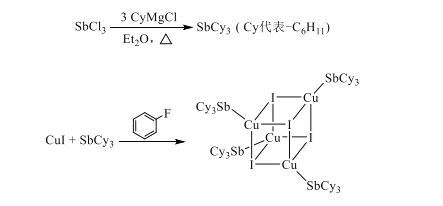
(1)已知SbCl3(三氯化锑)是挥发性显著的物质,由此判断SbCl3中主要含有的化学键类型是___。
(2)Sb为第四周期VA族元素,预测SbCl3的立体结构为___。
(3)Et2O(CH3CH2OCH2CH3,乙醚)中氧原子以及![]() 中碳原子的杂化类型分别是___、___。
中碳原子的杂化类型分别是___、___。
(4)CuI中Cu+的核外电子排布式为___。
(5)SbCy3只能与一个Cu+配位的原因是___。
(6)已知上述铜碘杂化团簇属四方晶系,晶胞参数分别为anm、bnm、cnm,棱间夹角为α=β=γ=90°,平均一个晶胞含有一个铜碘杂化团簇,该团簇的化学式为___。设阿伏加德罗常数的值为NA,已知SbCy的相对分子量是371,则该铜碘杂化团簇的密度是___g·cm-3(列计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 均为短周期主族元素,三种元素位于同一周期,
均为短周期主族元素,三种元素位于同一周期,![]() 两元素的最外层电子数之和与Z的最外层电子数相等,Y的最外层电子数是内层电子数的3倍。下列说法正确的是( )
两元素的最外层电子数之和与Z的最外层电子数相等,Y的最外层电子数是内层电子数的3倍。下列说法正确的是( )
A.原子半径:![]() B.最简单氢化物的热稳定性:
B.最简单氢化物的热稳定性:![]()
C.XZ为共价化合物D.![]() 的单质均不能与水发生反应
的单质均不能与水发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】青蒿素是从黄花蒿中提取的一种无色针状晶体,其结构如图1,请回答下列问题:
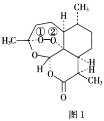
(1)基态O原子的价电子排布图为___。
(2)组成青蒿素的三种元素中电负性最大的是__(填元素符号,下同),第一电离能最大的是__。
(3)基态N原子的未成对电子数为___。
(4)双氢青蒿素是青蒿素的重要衍生物,其抗疟疾疗效优于青蒿素,双氢青蒿素的合成一般是在相转移催化剂聚乙二醇的作用下,用硼氢化钠(NaBH4)还原青蒿素。两种硼氢化物的合成原理如下:
2LiH+B2H6=2LiBH4;4NaH+BF3=NaBH4+3NaF
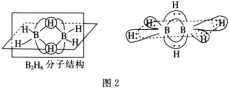
BH4-的空间构型为__;B2H6分子的结构如图2,B2H6中B的杂化方式为__。
聚乙二醇[HO(CH2CH2O)nH]随着n值的增大,水溶性降低,原因是___。
(5)NaH的晶胞与NaCl相同,NaH晶体中阳离子的配位数是__;设晶胞中阴、阳离子为刚性球体且恰好相切,阴、阳离子的半径比约为__(已知![]() ≈1.414,结果保留三位有效数字)。
≈1.414,结果保留三位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是中学化学中常见物质的转化关系,部分物质和反应条件略去。
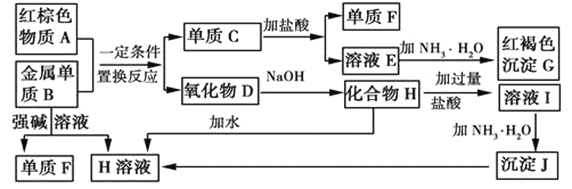
(1)单质F的化学式是___。
(2)写出由沉淀J生成 H溶液的离子方程式__。
(3)溶液E中加入氨水时,先生成白色沉淀L,写出生成L的离子方程式:__,白色沉淀L最终变为红褐色沉淀G,写出L变为G的化学反应方程式__。
(4)溶液I中所含金属离子是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有如下离子:H+、Mg2+、Al3+、NH4+、Cl-、AlO2-。当向该溶液中逐滴加入NaOH溶液时,产生沉淀的物质的量(n)与加入NaOH溶液的体积(V)的关系如图所示,下列说法正确的是( )

A. 原溶液中一定含有的阳离子是H+、Mg2+、Al3+、NH4+
B. 反应最后形成的溶液中的溶质含AlCl3
C. 原溶液中Al3+与NH的物质的量之比为1∶3
D. 原溶液中含有的阴离子是Cl-、AlO2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生产生活中常用84消毒液杀菌消毒。化学课外小组用Cl2和NaOH固体、水制取84消毒液。请回答下列问题:
(1)实验室制取Cl2的化学方程式为________,收集Cl2应使用_____法,要得到干燥的Cl2可选用_____作干燥剂,标准状况下,4.48LCl2的物质的量为______mol。
(2)制取84消毒液需要4.0mol·L-1的NaOH溶液100mL,配制时称量NaOH固体的质量为_____g,配制过程中使用的玻璃仪器有烧杯、玻璃棒、胶头滴管、_______。
(3)制取84消毒液的离子方程式为_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com