
【题目】生产生活中常用84消毒液杀菌消毒。化学课外小组用Cl2和NaOH固体、水制取84消毒液。请回答下列问题:
(1)实验室制取Cl2的化学方程式为________,收集Cl2应使用_____法,要得到干燥的Cl2可选用_____作干燥剂,标准状况下,4.48LCl2的物质的量为______mol。
(2)制取84消毒液需要4.0mol·L-1的NaOH溶液100mL,配制时称量NaOH固体的质量为_____g,配制过程中使用的玻璃仪器有烧杯、玻璃棒、胶头滴管、_______。
(3)制取84消毒液的离子方程式为_________。
【答案】MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O 向上排空气法(或排饱和食盐水法) 浓硫酸(或P2O5、无水CaCl2) 0.2 16.0 100mL容量瓶 Cl2+2OH-=Cl-+ClO-+H2O
MnCl2+Cl2↑+2H2O 向上排空气法(或排饱和食盐水法) 浓硫酸(或P2O5、无水CaCl2) 0.2 16.0 100mL容量瓶 Cl2+2OH-=Cl-+ClO-+H2O
【解析】
(1)在实验室中用浓盐酸与二氧化锰混合加热制取氯气,可根据其溶解性或密度大小收集气体;干燥气体时干燥剂只吸收水分,不与被干燥的气体反应;利用n=![]() 计算气体的物质的量;
计算气体的物质的量;
(2)根据n=c·V,m=n·M计算质量;利用配制物质的量浓度的步骤确定仪器;
(3)氯气与NaOH溶液反应产生NaCl、NaClO、H2O。
(1)在实验室中用浓盐酸与MnO2混合加热制取氯气,反应方程式为:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O;Cl2密度比空气大,可以用向上排空气方法收集;由于氯气与水的反应存在化学平衡,所以可根据化学平衡移动原理,用排饱和食盐水的方法收集氯气;Cl2是酸性气体,可以使用酸性干燥剂浓硫酸或P2O5干燥氯气;也可以使用无水CaCl2干燥氯气;根据n=
MnCl2+Cl2↑+2H2O;Cl2密度比空气大,可以用向上排空气方法收集;由于氯气与水的反应存在化学平衡,所以可根据化学平衡移动原理,用排饱和食盐水的方法收集氯气;Cl2是酸性气体,可以使用酸性干燥剂浓硫酸或P2O5干燥氯气;也可以使用无水CaCl2干燥氯气;根据n=![]() 可知在标准状况下,4.48LCl2的物质的量n(Cl2)=4.48L÷22.4L/mol=0.2mol;
可知在标准状况下,4.48LCl2的物质的量n(Cl2)=4.48L÷22.4L/mol=0.2mol;
(2)4.0mol·L-1的NaOH溶液100mL中含有NaOH的物质的量n(NaOH)=4.0mol/L×0.1L=0.4mol,所以NaOH的质量m(NaOH)=0.4mol×40g/mol=16.0g;配制100mL4.0mol/L的NaOH溶液的步骤为计算、称量、溶解、冷却、移液、洗涤、定容、摇匀,在配制过程中使用的玻璃仪器有烧杯、玻璃棒、胶头滴管、100mL容量瓶;
(3)84消毒液主要成分为NaClO,是氯气与NaOH溶液反应制成,则制取84消毒液的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O。


 快捷英语周周练系列答案
快捷英语周周练系列答案科目:高中化学 来源: 题型:
【题目】乙醇是一种重要的化工原料和燃料,常见合成乙醇的途径如下:
(1)乙烯气相直接水合法:C2H4(g)+H2O(g)=C2H5OH(g) ΔH1=akJ·mol-1
已知:C2H4(g)+3O2(g)=2CO2(g)+2H2O(g) ΔH2=-1323.0kJ·mol-1
C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g) ΔH3=-1278.5kJ·mol-1,则a=__。
(2)工业上常采用CO2和H2为原料合成乙醇,某实验小组将CO2(g)和H2(g)按1:3的比例置于一恒容密闭容器中发生反应:2CO2(g)+6H2(g)![]() C2H5OH(g)+3H2O(g) ΔH=bkJ·mol-1。在相同的时间内,容器中CO2的浓度随温度T的变化如图1所示,上述反应的pK(pK=-lgK,K表示反应平衡常数)随温度T的变化如图2所示。
C2H5OH(g)+3H2O(g) ΔH=bkJ·mol-1。在相同的时间内,容器中CO2的浓度随温度T的变化如图1所示,上述反应的pK(pK=-lgK,K表示反应平衡常数)随温度T的变化如图2所示。
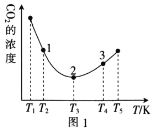
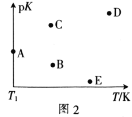
①由图1可知,b=__(填“![]() ”“
”“![]() ”或“<”)0。
”或“<”)0。
②在T1~T2及T4~T5两个温度区间内,容器中CO2(g)的浓度呈现如图1所示的变化趋势,其原因是___。
③图1中点1、2、3对应的逆反应速率v1、v2、v3中最大的是___(填“v1”“v2”或“v3”);要进一步提高H2(g)的转化率,可采取的措施有___(任答一条)。
④图2中当温度为T1时,pK的值对应A点,则B、C、D、E四点中表示错误的是__。
⑤乙烯气相直接水合法过程中会发生乙醇的异构化反应:C2H5OH(g)![]() CH3OCH3(g) ΔH=+50.7kJ·mol-1,该反应的速率方程可表示为v正=k正c(C2H5OH)和v逆=k逆c(CH3OCH3),k正和k逆只与温度有关。该反应的活化能Ea(正)__(填“
CH3OCH3(g) ΔH=+50.7kJ·mol-1,该反应的速率方程可表示为v正=k正c(C2H5OH)和v逆=k逆c(CH3OCH3),k正和k逆只与温度有关。该反应的活化能Ea(正)__(填“![]() ”“
”“![]() ”或“<”) Ea(逆),已知:T℃时,k正=0.006s-1,k逆=0.002s-1,该温度下向某恒容密闭容器中充入1.5mol乙醇和4mol甲醚,此时反应__(填“正向”或“逆向”)进行。
”或“<”) Ea(逆),已知:T℃时,k正=0.006s-1,k逆=0.002s-1,该温度下向某恒容密闭容器中充入1.5mol乙醇和4mol甲醚,此时反应__(填“正向”或“逆向”)进行。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】称取58.7克Ba(OH)2和BaCl2固体混合物,配成500mL溶液,把该溶液分成5等份后分别加入相同浓度不同体积的NaHCO3溶液,生成沉淀的质量如下表。已知加入NaHCO3溶液体积为80.0mL时,反应后溶液呈中性。
实验序号 | Ⅰ | Ⅱ | Ⅲ | Ⅳ | Ⅴ |
NaHCO3溶液(mL) | 20.0 | 40.0 | 60.0 | 80.0 | 100.0 |
沉淀的质量(g) | 1.97 | 3.94 | 5.91 | 7.88 | 7.88 |
(1)NaHCO3溶液中溶质的物质的量浓度______________________。
(2)原固体混合物中Ba(OH)2和BaCl2的物质的量之比__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,向体积恒定为2L的密闭容器里充入2mol M和一定量的N,发生如下反应:M(g)+ N(g)![]() E(g);当反应进行到4min时达到平衡,测知M的浓度为0.2molL-1.下列说法正确的是( )
E(g);当反应进行到4min时达到平衡,测知M的浓度为0.2molL-1.下列说法正确的是( )
A. 4min时,M的转化率为80%
B. 4min时,用M表示的反应速率为0.8molL-1min-1
C. 4min后,向容器中充入不参与反应的稀有气体,M的物质的量减小
D. 2min时,M的物质的量浓度为0.6molL-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组报用含稀硫酸的KMnO4,溶液与H2C2O4溶液(弱酸)的反应(此反应为放热反应)来探究"条件对化学反应速率的影响",并设计了如表的方案记录实验结果(忽略溶液混合体积变化),限选试剂和仪器:0.2mol L-1H2C2O4溶液、0.010mol·L-1KMnO4溶液(酸性)、蒸馏水、试管、量筒、秒表、恒温水浴槽
项目 | V(0.2mol L-1H2C2O4溶液)/mL | V(蒸馏水)/mL | V(0.010mol·L-1KMnO4溶液)/mL | M(MnSO4固体)/g | T/℃ | 乙 |
① | 2.0 | 0 | 4.0 | 0 | 50 | |
② | 2.0 | 0 | 4.0 | 0 | 25 | |
③ | 1.0 | a | 4.0 | 0 | 25 | |
④ | 2.0 | 0 | 4.0 | 0.1 | 25 |
回答下列问题
(1完成上述反应原理的化学反应方程式____________________________________
(2)上述实验①②是探究___________对化学反应速率的影响;若上述实验②③是探究浓度的对化学反应速率的影响,则a为______;乙是实验需要测量的物理量,则表格中“乙”应填写_______;上述实验②④是探究__________对化学反应速率的影响
(3)已知草酸为二元弱酸,其电离方程式为___________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用右图所示的装置及药品进行酸性强弱比较的实验,下列说法不正确的是
A.①和②中发生的反应均为复分解反应
B.向Na2SiO3饱和溶液中滴酚酞溶液无明显现象
C.一段时间后②中有胶冻状物质生成
D.该实验能证明酸性强弱的顺序是:硫酸>碳酸>硅酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取标准状况下2.24升由两种气态烃组成的混合气体,完全燃烧后得到4.48升二氧化碳(标准状况下)和3.6克水,这混合气体可能是
A.CH4、C3H8B.C2H4、C3H4C.CH4、C3H4D.C2H2、C3H8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组数据中,前者刚好是后者两倍的是( )
A.200 mL 1 mol·L-1氯化钙溶液中c(Cl-)和100 mL 2 mol·L-1氯化钾溶液中c(Cl-)
B.2 molCO的摩尔质量和1 mol CO的摩尔质量
C.64 g二氧化硫中氧原子数和标准状况下22.4 LCO中氧原子数
D.20% NaOH溶液中NaOH的物质的量浓度和10% NaOH溶液中NaOH的物质的量浓度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com