
【题目】(1)烷烃C5H12的一种同分异构体只能生成一种一氯代物,该异构体的结构简式为______。
(2)2,2,3,3-四甲基戊烷的结构简式为:___________。
(3)![]() 的系统命名:________。
的系统命名:________。
(4)1mol不饱和烃可以和1molCl2发生加成反应,生成2-甲基-2,3-二氯戊烷,则该不饱和烃的结构简式是:______。
(5)相对分子量相近的醇和烷烃相比,醇的沸点远远高于烷烃,原因是__________。
(6)相同质量的甲烷,乙烷,乙烯和乙炔,完全燃烧后生成CO2最多的是_________。
【答案】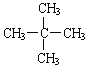 C(CH3)3C(CH3)2CH2CH3 2-甲基-1-丁烯 (CH3)2C=CH-CH2CH3 醇分子之间形成了氢键 乙炔
C(CH3)3C(CH3)2CH2CH3 2-甲基-1-丁烯 (CH3)2C=CH-CH2CH3 醇分子之间形成了氢键 乙炔
【解析】
(1)烷烃C5H12的一种同分异构体只能生成一种一氯代物,则该物质只含有一种位置的H原子,据此书写结构简式;
(2)烷烃主链上有五个C原子,在主链的2、3号C原子上分别有2个甲基,然后根据烷烃的C原子价电子为4,用H原子补齐,即得该物质的结构简式;
(3)从左端给主链上C原子编号,以确定碳碳双键和甲基在主链上的位置,然后对其命名;
(4)将2-甲基-2,3-二氯戊烷的2个Cl原子去掉,将碳碳单键改为碳碳双键,就是该物质的结构简式;
(5)醇的分子之间有氢键,增加了分子之间的吸引力,使物质的熔沸点增大;
(6)等质量的物质,C元素的含量越多,反应产生的CO2也越多。
(1)烷烃C5H12的一种同分异构体只能生成一种一氯代物,则该物质只含有一种位置的H原子,该物质的结构简式为 ;
;
(2) 2,2,3,3-四甲基戊烷的结构简式为C(CH3)3C(CH3)2CH2CH3;
(3)从左端给主链上C原子编号,以确定碳碳双键和甲基在主链上的位置,然后用系统命名方法对其命名为2-甲基-1-丁烯;
(4)将2-甲基-2,3-二氯戊烷的2个Cl原子去掉,将碳碳单键改为碳碳双键,就是该物质的结构简式为(CH3)2C=CH-CH2CH3;
(5)相对分子量相近的醇和烷烃相比,由于醇分子之间有氢键,增加了醇分子之间的吸引力,从而使醇的沸点远远高于相应烷烃;
(6)相同质量的甲烷,乙烷,乙烯和乙炔中,C元素的含量最高的是乙炔,碳元素的含量越多,等质量的物质中C元素的质量就越多,则其完全燃烧后生成CO2也最多。因此相同质量的甲烷,乙烷,乙烯和乙炔,完全燃烧后生成CO2最多的是乙炔。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】等质量的下列各组混合物完全燃烧生成CO2的质量由大到小是( )
①C2H6 C3H8 ②C3H4 C3H6 ③C3H6 C2H4 ④C4H10 C3H8 ⑤C2H2 C3H4
A. ⑤②③④①B. ②③⑤④①C. ①②③④⑤D. ⑤②③①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一个完整的氧化还原反应方程式可以拆开,写成两个“半反应式”,一个是“氧化反应式”,一个是“还原反应式”。如Fe+Cu2+=Fe2++Cu,可拆写为氧化反应式:Fe-2e-=Fe2+,还原反应式:Cu2++2e-=Cu。据此,回答下列问题:
(1)将反应Zn+2H+=Zn2++H2↑拆写为两个“半反应式”:
氧化反应式:_______________________,还原反应式:_______________________。
(2)将反应2Fe3++Cu=2Fe2++Cu2+拆写为两个“半反应式”:
氧化反应式:_______________________,还原反应式:_______________________。
(3)已知某反应的两个“半反应式”为:氧化反应式CH4+10OH--8e-=![]() +7H2O,还原反应式O2+2H2O+4e-=4OH-,则氧化还原反应方程式为___________________。
+7H2O,还原反应式O2+2H2O+4e-=4OH-,则氧化还原反应方程式为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】完成下列填空。
(1)100ml0.1mol/L的Na2SO4溶液中所含Na+的数目为___。
(2)同温同压下,同体积的甲烷和二氧化碳分子数之比为___,密度之比为___。
(3)某气态氧化物化学式为RO2,在标准状况下,1.28g该氧化物的体积是448mL,则氧化物的摩尔质量为__,R的相对原子质量为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼(B)可形成H3BO3、NaBH4、NaBO2等化合物,用途广泛。
(1)H3BO3为一元弱酸,常温下,在水中存在如下电离平衡:
H3BO3 + H2O![]() [B(OH)4]-+H+,Ka=5.72×10-10。
[B(OH)4]-+H+,Ka=5.72×10-10。
① 25℃时,0.175 mol/L的H3BO3溶液pH约为_________(取整数)。
② 已知碳酸H2CO3的电离平衡常数为Ka1 = 4.4×10-7,Ka2 = 5.6×10-11。将少量碳酸钠溶液滴加到饱和硼酸溶液中,反应的离子方程式为_________。
(2)在容积恒定为2 L的密闭容器中加入足量BPO4和Na固体并充入一定量的H2(g)发生储氢反应:BPO4(s)+4Na(s)+2H2(g)![]() Na3PO4(s)+NaBH4(s) △H<0
Na3PO4(s)+NaBH4(s) △H<0
① 体系中H2的物质的量与反应时间的关系如表所示:
t /min | 0 | 2 | 4 | 6 | 8 | 10 |
n(H2)/mol | 2.0 | 1.5 | 1.2 | 0.9 | 0.8 | 0.8 |
下列有关叙述正确的是(填标号)_________。
a. 当容器内气体的摩尔质量不再变化时,反应达到平衡状态
b. 10 min时向容器内通入少量H2,则重新达平衡前ν(放氢)> ν(吸氢)
c. 保持温度不变,平衡后再充入1 mol H2,达新平衡时H2的浓度为0.4 mol/L
d. 升高温度,放氢速率加快,重新达到平衡时容器压强增大
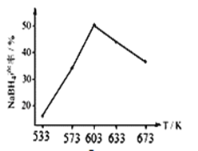
② 下图为相同时间,NaBH4的产率与反应温度的关系曲线。NaBH4的产率在603K之前随温度升高而增大的原因是_________。
(3)NaBH4(s)遇H2O(l)剧烈水解,生成氢气和NaBO2(s)。
① 通常状况下,实验测得3.8gNaBH4(s)发生水解反应放出21.6 kJ热量,写出该反应的热化学方程式_________。
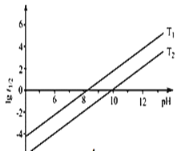
② t1/2为NaBH4水解的半衰期(水解一半所需要的时间,单位为min)。lg t1/2随pH和温度的变化如图所示。溶液pH=4时,NaBH4________(填“能”或“不能”)稳定存在;T1_________T2。(填 “>”或“<”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机化合物A的蒸气对氢气的相对密度为30, 分子中含碳40%,含氢6.6%,其余为氧。此有机物既可与金属钠反应,又可与氢氧化钠和碳酸钠反应。
(1)通过计算确定该有机物的分子式______;
(2)根据该有机物的性质,写出其结构简式_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】PtCl2(NH3)2可以形成两种固体,一种为淡黄色,在水中的溶解度小,另一种为黄绿色,在水中的溶解度较大,请回答下列问题:
(1)PtCl2(NH3)2是平面正方形结构,还是四面体结构______________
(2)请在以下空格内画出这两种固体分子的几何构型图,淡黄色固体:________ 黄绿色固体:________
(3)淡黄色固体物质是由________分子组成,黄绿色固体物质是由_______分子组成(填“极性分子”或“非极性分子”)
(4)黄绿色固体在水中溶解度比淡黄色固体大,原因是_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下在容积不变的密闭容器中进行如下可逆反应:
SiF4(g)+2H2O(g)SiO2(s)+4HF(g),下列能表明该反应已达到化学平衡状态的是
①v正(SiF4)=4v逆(HF)②HF的体积分数不再变化③容器内气体压强不再变化
④混合气体的密度保持不变⑤4molO—H键断裂的同时,有2molH—F键断裂
A.①②③④B.②③④C.②⑤D.③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是A、B、C、D四种有机物的有关信息:
A | ①能使溴的四氯化碳溶液褪色;②比例模型为: |
B | ①由C、H两种元素组成;②球棍模型为 |
C | ①由C、H、O三种元素组成;②能与Na反应,但不能与NaOH溶液反应;③能与D反应生成相对分子质量为100的酯 |
D | ①由C、H、O三种元素组成;②球棍模型为 |
回答下列问题:
(1)A与溴的四氯化碳溶液反应的生成物的官能团名称为________。写出A在一定条件下反应生成高分子化合物的方程式:___________________。
(2)A与氢气发生加成反应后生成物质E,与E在分子组成和结构上相似的有机物有一大类(俗称“同系物”),它们均符合通式CnH2n+2。当n=___________________时,这类有机物开始出现同分异构体。
(3)关于B的说法正确的是:___________________。
a、所有原子在同一个平面上 b、六个碳原子之间是单双建交替的结构
c、一个B分子含有6个σ键 d、含有苯环的化合物成为芳香化合物
(4)C与D反应能生成相对分子质量为100的酯,该反应的反应类型为___________________;其化学方程式为___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com