
(1)K2Cr2O7+HCl(浓)——KCl+CrCl3+Cl2↑+H2O
(2)Cu2++FeS2+□□——Cu2S+![]() +Fe2++□□
+Fe2++□□
(3)将NaBiO3固体(黄色,微溶)加入MnSO4和H2SO4的混合溶液里,加热,溶液显紫色(Bi3+无色)。配平该反应的离子方程式:NaBiO3+□Mn2++□H+![]() □Na++□Bi3++□□+□□
□Na++□Bi3++□□+□□
解析:(1)分析化合价的变化:
K2Cr2O7+HCl(浓)——KCl+CrCl3+Cl2↑+H2O
↓3×2 ↑2×3
CrCl3和Cl2的计量数分别是2和3,然后用观察法配平得:
K2Cr2O7+14HCl(浓)====2KCl+2CrCl3+3Cl2↑+7H2O
(2)先用化合价升降法配平可得:
14Cu2++5FeS2+_____——7Cu2S+3![]() +5Fe2++____+____
+5Fe2++____+____
,再比较方程式两边的原子、原子团及电荷数可知,生成物比反应物多了12 mol 氧原子,少了24 mol正电荷。在题中条件下,要增加12 mol氧原子可加12 mol水,生成24 mol H+,则反应方程式为:14Cu2++5FeS2+12H2O====7Cu2S+3![]() +5Fe2++24H+,当然此题在反应中加24 mol OH-,在生成物中加12 mol水也平衡,只是不合题给条件。
+5Fe2++24H+,当然此题在反应中加24 mol OH-,在生成物中加12 mol水也平衡,只是不合题给条件。
(3)可先确定氧化剂和还原剂的化学计量数,溶液呈紫色说明有![]() 生成。
生成。
化合价分析如下:![]() →
→![]() 化合价降2×5,
化合价降2×5,![]() →
→![]() 化合价升5×2。
化合价升5×2。
5和2分别为NaBiO3和Mn2+的化学计量数,用观察法确定有关物质的化学计量数,根据质量守恒定律,生成物应补上7H2O。
答案:(1)K2Cr2O7+14HCl(浓)====2KCl+2CrCl3+3Cl2↑+7H2O
(2)14Cu2++5FeS2+12H2O====7Cu2S+3![]() +5Fe2++24H+
+5Fe2++24H+
(3)5NaBiO3+2Mn2++14H+====5Na++5Bi3++2![]() +7H2O
+7H2O


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| ① |
| ④ |
| ② |
| ③ |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 (1)测定Na2O和Na的混合物中金属钠的质量分数可用下图所示的几套仪器组合:
(1)测定Na2O和Na的混合物中金属钠的质量分数可用下图所示的几套仪器组合:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:同步题 题型:填空题
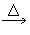 CO2↑+SO2↑+H2O______________________
CO2↑+SO2↑+H2O______________________  NO+H2O______________________
NO+H2O______________________ 查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com