
【题目】乳酸亚铁晶体{[CH3CH(OH)COO]2Fe·3H2O}(相对分子质量:288)可由乳酸与FeCO3反应制得,它易溶于水,几乎不溶于乙醇,受热易分解,是一种很好的补铁剂。
乳酸亚铁晶体纯度的测量:用K2Cr2O7滴定法测定样品中Fe2+的含量计算样品纯度,称取6.00g样品配制成250.00mL溶液。取25.00mL用0.0167mol·L-1的K2Cr2O7标准溶液滴定至终点,消耗标准液20.00mL。则产品中乳酸亚铁晶体的纯度为___(以质量分数表示)。
 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案科目:高中化学 来源: 题型:
【题目】某同学在实验室进行铁盐与亚铁盐相互转化的实验:
实验Ⅰ:将![]() 转化为
转化为![]() 如图
如图![]()
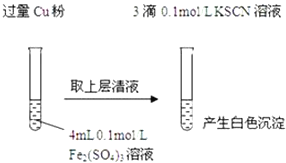
(1)Fe3+与Cu粉发生反应的离子方程式为______.
(2)探究白色沉淀产生的原因,请填写实验方案:查阅资料:
![]() 的化学性质与
的化学性质与![]() 相似,
相似,![]() 白色
白色![]()
实验方案 | 现象 | 结论 |
步骤1:取4mL ______ | 产生白色沉淀 |
|
步骤2:取 ______ | 无明显现象 |
![]() 与
与![]() 反应的离子方程式为______.
反应的离子方程式为______.
实验Ⅱ:将![]() 转化为
转化为![]()
实验方案 | 现象 |
向3mL | 溶液变为棕色,放置一段时间后,棕色消失,溶液变为黄色 |
探究上述现象出现的原因:查阅资料:![]() 棕色
棕色![]()
(3)用离子方程式解释NO产生的原因______.
(4)从化学反应速率与限度的角度对体系中存在的反应进行
反应Ⅰ:![]() 与
与![]() 反应;反应Ⅱ:
反应;反应Ⅱ:![]() 与NO反应
与NO反应
①依据实验现象,甲认为反应Ⅰ的速率比反应Ⅱ______![]() 填“快”或“慢”
填“快”或“慢”![]() .
.
②乙认为反应Ⅰ是一个不可逆反应,并通过实验证明其猜测正确,乙设计的实验方案是______.
③请用化学平衡移动原理解释溶液由棕色变为黄色的原因______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列涉及有机物的性质或应用的说法不正确的是![]()
A.淀粉、纤维素、蛋白质都是天然高分子化合物
B.用于奥运“祥云”火炬的丙烷是一种清洁燃料
C.乙酸和油脂都能与氢氧化钠溶液反应
D.纤维素、蔗糖、葡萄糖和脂肪在一定条件下都可发生水解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器内,进行反应:CO(g)+H2O(g)![]() CO2(g)+H2(g)。
CO2(g)+H2(g)。
得到如下两组数据:
实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需要的时间/min | ||
H2O | CO | H2 | CO | |||
1 | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
①实验1中以v(CO2)表示的反应速率为___。
②该反应的逆反应为___(填“吸”或“放”)热反应。
(2)在一容积为2L的密闭容器内加入2mol的CO和6mol的H2,在一定条件下发生如下反应:CO(g)+2H2(g)![]() CH3OH(g) △H<0该反应的逆反应速率与时间的关系如图所示:
CH3OH(g) △H<0该反应的逆反应速率与时间的关系如图所示:

①由图可知反应在t1、t3、t7时都达到平衡,而在t2、t8时都改变了条件,试从以下措施中选出适宜的改变条件:t2___、t8___。(此处两空均填下列选项字母序号)
a.增加CO的物质的量 b.加催化剂 c.升高温度 d.压缩容器体积 e.将CH3OH气体液化 f.充入氦气
②若t4时降压,t5时达到平衡,t6时增大反应物的浓度,请在图中画出t4~t6时逆应速率与时间的关系曲线___。
(3)已知反应2NO(g)+2CO(g)![]() N2(g)+2CO2(g)在100kPa下△H=-113.0kJ/mol,△S=-145.3J·mol-1·K-1。理论上,该反应在温度___(填“高于”或“低于”)___时均可自发进行。
N2(g)+2CO2(g)在100kPa下△H=-113.0kJ/mol,△S=-145.3J·mol-1·K-1。理论上,该反应在温度___(填“高于”或“低于”)___时均可自发进行。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由两种金属组成的合金10g投入足量的稀硫酸中,反应完全后得到氢气11.2L(标准状况下),此合金可能是 ( )
A.镁铝合金B.镁铁合金C.铝铁合金D.镁锌合金
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】胆矾(CuSO4·5H2O)是铜的重要化合物,在工业生产中应用广泛。若改变反应条件可获得化学式为Cux(OH)y(SO4)z·nH2O的晶体,用热重分析仪对Cux(OH)y(SO4)z·nH2O晶体进行分析并推断该晶体的化学式。取3.30 g晶体样品进行热重分析,所得固体质量的变化曲线如图所示。已知:体系温度在650 ℃及以下时,放出的气体只有水蒸气;实验测得温度在650℃时,残留固体的组成可视为aCuO·bCuSO4;温度在1 000 ℃以上时,得到的固体为Cu2O。请回答下列问题:

①温度650~1 000 ℃产生的气体中,n(O)∶n(S)____(填“>”“<”或“=”)3。
②通过计算推断Cux(OH)y(SO4)z·nH2O晶体的化学式:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等物质的量的A、B混合于2L的密闭容器中,发生如下反应:3A(g)+B(g)![]() xC(g)+2D(g),经5min后,测得D的浓度为0.5mol/L,c(A):c(B)=3:5,C的平均反应速率为0.1 mol/(Lmin),试求:(1)x的值_______;
xC(g)+2D(g),经5min后,测得D的浓度为0.5mol/L,c(A):c(B)=3:5,C的平均反应速率为0.1 mol/(Lmin),试求:(1)x的值_______;
(2)5min时A的浓度_______;
(3)此5min内B的转化率_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列说法正确的是
A.c(NH4+)相同的①(NH4)2SO4、②(NH4)2CO3、③(NH4)2Fe(SO4)2、④NH4I溶液,其溶质物质的量浓度大小为④>②>③>①
B.0.2 mol·L-1 HCl溶液与等体积0.05 mol·L-1 Ba(OH)2溶液混合后,溶液的pH为1
C.NaHCO3溶液中: c(HCO3-)+ c(CO32-)+ 2c(H2CO3)=c(OH-)
D.浓度均为0.1 mol·L-1的CH3COOH、CH3COONa混合溶液中:c(CH3COO-)+c(OH-)>c(CH3COOH)+c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是通过 Li-CO2 电化学技术实现储能系统和 CO2 固定策略的示意团。储能系统使用的电池组成为钌电极/CO2 饱和 LiClO4-(CH3)2SO(二甲基亚砜)电解液/锂片,下列说法不正确的是
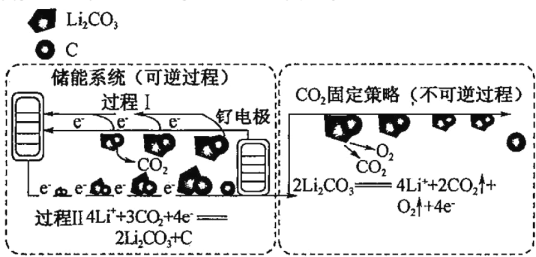
A.Li-CO2 电池电解液为非水溶液
B.CO2 的固定中,转秱 4mole-生成 1mol 气体
C.钌电极上的电极反应式为 2Li2CO3+C - 4e-=4Li++3CO2↑
D.通过储能系统和 CO2 固定策略可将 CO2 转化为固体产物 C
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com