
【题目】(1)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器内,进行反应:CO(g)+H2O(g)![]() CO2(g)+H2(g)。
CO2(g)+H2(g)。
得到如下两组数据:
实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需要的时间/min | ||
H2O | CO | H2 | CO | |||
1 | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
①实验1中以v(CO2)表示的反应速率为___。
②该反应的逆反应为___(填“吸”或“放”)热反应。
(2)在一容积为2L的密闭容器内加入2mol的CO和6mol的H2,在一定条件下发生如下反应:CO(g)+2H2(g)![]() CH3OH(g) △H<0该反应的逆反应速率与时间的关系如图所示:
CH3OH(g) △H<0该反应的逆反应速率与时间的关系如图所示:

①由图可知反应在t1、t3、t7时都达到平衡,而在t2、t8时都改变了条件,试从以下措施中选出适宜的改变条件:t2___、t8___。(此处两空均填下列选项字母序号)
a.增加CO的物质的量 b.加催化剂 c.升高温度 d.压缩容器体积 e.将CH3OH气体液化 f.充入氦气
②若t4时降压,t5时达到平衡,t6时增大反应物的浓度,请在图中画出t4~t6时逆应速率与时间的关系曲线___。
(3)已知反应2NO(g)+2CO(g)![]() N2(g)+2CO2(g)在100kPa下△H=-113.0kJ/mol,△S=-145.3J·mol-1·K-1。理论上,该反应在温度___(填“高于”或“低于”)___时均可自发进行。
N2(g)+2CO2(g)在100kPa下△H=-113.0kJ/mol,△S=-145.3J·mol-1·K-1。理论上,该反应在温度___(填“高于”或“低于”)___时均可自发进行。
【答案】0.16mol/(Lmin) 放 c b 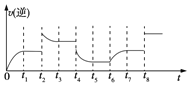 低于 777.7K
低于 777.7K
【解析】
(1)①由表中数据可知,CO的物质的量变化量为4mol-2.4mol=1.6mol,根据v=![]() 计算v(CO),再利用速率之比等于化学计量数之比计算v(CO2);
计算v(CO),再利用速率之比等于化学计量数之比计算v(CO2);
②第二组温度比第一组高,反应物物质的量比第一组减半,但是平衡时CO2的物质的量比第一组的一半少,表明该反应为放热反应;
(2)根据影响化学平衡的因素分析;①催化剂可以加快反应速率,但不影响平衡移动;
②减小压强,速率减慢,增大浓度,反应速率加快;
(3)依据△G=△H-T△S计算判断,若△G<0,反应自发进行,若△G>0,反应非自发进行。
(1)①由表中数据可知,CO的物质的量变化量为4mol-2.4mol=1.6mol,v(CO)=![]() =
=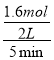 =0.16mol/(Lmin),速率之比等于化学计量数之比,故v(CO2)=v(CO)=0.16mol/(Lmin);故答案为:0.16mol/(Lmin);
=0.16mol/(Lmin),速率之比等于化学计量数之比,故v(CO2)=v(CO)=0.16mol/(Lmin);故答案为:0.16mol/(Lmin);
②由表中数据可知,实验1中CO的物质的量变化量为4mol-2.4mol=1.6mol,实验1中CO的转化率为![]() ×100%=40%,实验2中CO的物质的量变化量为2mol-1.6mol=0.4mol,实验2中CO的转化率为
×100%=40%,实验2中CO的物质的量变化量为2mol-1.6mol=0.4mol,实验2中CO的转化率为![]() ×100%=20%,则实验1的转化率大于实验2,则说明温度升高平衡向逆反应方向移动,正反应放热;故答案为“放”;
×100%=20%,则实验1的转化率大于实验2,则说明温度升高平衡向逆反应方向移动,正反应放热;故答案为“放”;
(2)①根据图可知,t2速率加快,平衡逆向移动,根据反应特点,改变的条件为:升高温度,答案选:c;t8时反应速率加快,但平衡未移动,故使用了催化剂,答案选:b;
②t4时降压,速率减慢,t5时达到平衡,t6时增大反应物的浓度,反应速率加快,故t4~t6时逆反应速率与时间的关系曲线为: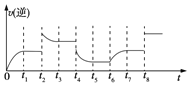 ;故答案为:
;故答案为: ;
;
(3)已知:在100kPa下该反应的△H=-113.0kJmol-1,△S=-145.3Jmol-1K-1,反应自发进行,△G=△H-T△S=-113.0 kJmol-1-T ×(-145.3 Jmol-1K-1)×10-3<0,计算出T<777.7K,故答案为:低于;777.7K。


科目:高中化学 来源: 题型:
【题目】海水约占地球总储水量的97%。若把海水淡化和化工生产结合起来,既可以解决淡水资源缺乏的问题,又可以充分利用海洋资源。
(1)海水中含有大量氯化钠,氯化钠的电子式为________________,氯化钠中的非金属元素在元素周期表中的位置为第________周期第________族。
(2)目前,国际上广泛应用的海水淡化的主要技术之一是蒸馏法。蒸馏法是将海水变成蒸汽,蒸汽经过冷却而得到高纯度淡水,由此可判断蒸馏的过程中发生的是________(填“物理变化”或“化学变化”)。
(3)工业上利用电解饱和食盐水可制得重要化工产品,反应方程式为________________________,检验阳极产物的方法是________________________。
(4)工业上从海水中提取溴,第一步是将氯气通入富含溴离子的海水中,将溴置换出来;第二步用空气把溴吹出,用SO2的水溶液吸收,使溴转化为氢溴酸;第三步用氯气氧化氢溴酸即得单质溴。写出上述过程中第一、二步发生反应的离子方程式:①______________________;②____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.![]() 的一溴代物和
的一溴代物和 ![]() 的一溴代物都有4种(不考虑立体异构)
的一溴代物都有4种(不考虑立体异构)
B.CH3CH=CHCH3 分子中的四个碳原子在同一直线上
C.按系统命名法,化合物 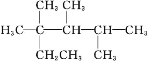 的名称是:2,3,4-三甲基-2-乙基戊烷
的名称是:2,3,4-三甲基-2-乙基戊烷
D.C6H14的同分异构体有4种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表中各组物质之间不能通过一步反应实现如图转化的是
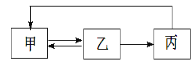
甲 | 乙 | 丙 | |
A | CH2=CH2 | CH3CH2Cl | CH3CH2OH |
B | NH3 | NO | HNO3 |
C | AlCl3 | Al(OH)3 | Al2O3 |
D | Cl2 | HCl | CuCl2 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯的产量是衡量一个国家石油化工发展水平的重要标志之一,以乙烯为原料合成的部分产品如图所示。下列有关说法正确的是
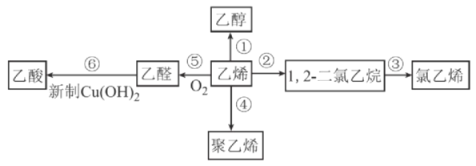
A.氧化反应有①⑤⑥,加成反应有②③
B.氯乙烯、聚乙烯都能使酸性KMnO4溶液褪色
C.反应⑥的现象为产生砖红色沉淀
D.可用乙醇萃取Br2的CCl4溶液中的Br2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石油裂化可得到有机物(CH3)2C=C(CH3)2(以下用A表示)。
(1)A的系统命名为________;A在通常状况下呈________(填“气”“液”或“固”)态。
(2)A与Br2的加成产物B与NaOH的乙醇溶液共热可生成二烯烃C,则C的结构简式为___________________;B生成C的反应类型为________。
(3)C与一定量Br2反应可能生成D、E和G,而D与HBr的加成产物只有F,则D形成高分子化合物的化学方程式为__________________________________________。
(4)C的同分异构体中不可能为________(填字母)
a.芳香烃 b.炔烃 c.环烯烃 d.二烯烃
若C的一种同分异构体H与KMnO4酸性溶液生成己二酸,则H的结构简式为________;
查看答案和解析>>
科目:高中化学 来源: 题型:
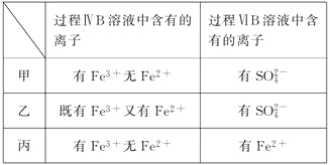
【题目】为验证氧化性:Cl2>Fe3+>SO2,某小组用下图所示装置进行实验(夹持仪器和A中的加热装置已略,气密性已经检验完毕)实验过程如图:

Ⅰ.打开弹簧夹K1~K4,通入一段时间N2,再将T形导管插入B中,继续通入N2,然后关闭K1、K3、K4。
Ⅱ.打开活塞a,滴加一定量的浓盐酸,给A加热。
Ⅲ.当B中溶液变黄时,停止加热,夹紧弹簧夹K2。
Ⅳ.打开活塞b,使约2 mL的溶液流入D试管中,检验其中的阳离子。
Ⅴ.打开弹簧夹K3、活塞c,加入70%的硫酸,一段时间后夹紧弹簧夹K3。
Ⅵ.更新试管D,重复过程Ⅳ,检验B溶液中的离子。
(1)过程Ⅰ的目的是________________________。
(2)棉花中浸润的溶液为__________________。作用是_______________________。
(3)A中发生反应的化学方程式:______________________________________。
(4)导致步骤Ⅲ中溶液变黄的离子反应是______________________________。用______________(写试剂化学式)检验氧化产物,现象是___________________________。
(5)能说明氧化性Fe3+>SO2的离子方程式是__________________________。
(6)甲、乙、丙三位同学分别完成了上述实验,他们的检测结果一定能够证明氧化性Cl2>Fe3+>SO2的是________________(填“甲”“乙”或“丙”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图形象地表示了氯化钠的形成过程,下列相关叙述中,不正确的是( )

A. 钠原子易失去一个电子,氯原子易得到一个电子
B. 钠离子与钠原子有相似的化学性质
C. 钠原子与氯原子作用生成NaCl后,其结构的稳定性增强
D. 氯化钠是离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素 X、Y、Z、Q、R 的原子序数依次增大,X 的简单阴离子与锂离子具有相同的电子层结构,Y原子最外层电子数等于内层电子数的2倍,Q 的单质与稀硫酸剧烈反应生成 X 的单质。向100mLX2R的水溶液中缓缓通入RZ2 气体,溶液pH与RZ2 体积关系如下图。下列说法正确的是( )
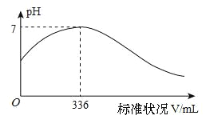
A. X2R 溶液的浓度为0.03mol·L-1
B. 最简单气态氢化物的稳定性:Y>Z>R
C. 工业上通常采用电解法冶炼Q的单质
D. RZ2 通入 BaCl2、Ba(NO3)2 溶液中,均无明显现象
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com