
����Ŀ��Ϊ��֤�����ԣ�Cl2��Fe3����SO2��ijС������ͼ��ʾװ�ý���ʵ��(�г�������A�еļ���װ�����ԣ��������Ѿ��������)ʵ�������ͼ��

��.���ɼ�K1��K4��ͨ��һ��ʱ��N2���ٽ�T�ε��ܲ���B�У�����ͨ��N2��Ȼ��ر�K1��K3��K4��
��.����a���μ�һ������Ũ���ᣬ��A���ȡ�
��.��B����Һ���ʱ��ֹͣ���ȣ��н����ɼ�K2��
��.����b��ʹԼ2 mL����Һ����D�Թ��У��������е������ӡ�
��.���ɼ�K3������c������70%�����ᣬһ��ʱ���н����ɼ�K3��
��.�����Թ�D���ظ����̢�������B��Һ�е����ӡ�
(1)���̢��Ŀ����________________________��
(2)���н������ҺΪ__________________��������_______________________��
(3)A�з�����Ӧ�Ļ�ѧ����ʽ��______________________________________��
(4)���²��������Һ��Ƶ����ӷ�Ӧ��______________________________����______________(д�Լ���ѧʽ)�����������������___________________________��
(5)��˵��������Fe3����SO2�����ӷ���ʽ��__________________________��
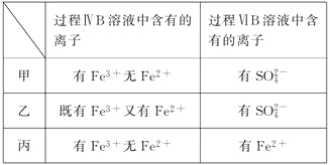
(6)�ס��ҡ�����λͬѧ�ֱ����������ʵ�飬���ǵļ����һ���ܹ�֤��������Cl2��Fe3����SO2����________________(��ס����ҡ�����)��
���𰸡� �ų�װ���е����� ����������Һ ����Cl2��SO2����ֹ��Ⱦ���� MnO2��4HCl(Ũ)![]() MnCl2��Cl2����2H2O 2Fe2����Cl2===2Fe3����2Cl���� KSCN�� ��Һ��� 2Fe3����SO2��2H2O===2Fe2����SO
MnCl2��Cl2����2H2O 2Fe2����Cl2===2Fe3����2Cl���� KSCN�� ��Һ��� 2Fe3����SO2��2H2O===2Fe2����SO![]() ��4H�� �ұ�
��4H�� �ұ�
����������1������װ���к��п����ܸ���ʵ���жϣ�
��2�����������Ͷ�����������Ⱦ����������
��3������Aװ���Ʊ��������
��4�����������������������ӷ�����
��5�������������ܰѶ�����������Ϊ���������
��6��������������������ǿ����������������Է����жϡ�
��1�����ɼ�K1��K4��ͨ��һ��ʱ��N2��Ŀ�����ų�װ���е���������ֹ����ʵ�顣
��2�����н����Ϊ����������Һ�����ܹ����շ�Ӧ�ж���������������������壬��ֹ��Ⱦ������
��3��A��Ϊ����������Ũ������ȷ�Ӧ�����������Ȼ��̺�ˮ����Ӧ�Ļ�ѧ����ʽΪMnO2+4HCl(Ũ)![]() MnCl2+Cl2��+2H2O��
MnCl2+Cl2��+2H2O��
��4����������ǿ�����ԣ��ܹ����Ȼ���������Ϊ�Ȼ�����������������Һ�Ի�ɫ�����ӷ�Ӧ����ʽ�ǣ�2Fe2++Cl2=2Fe3++2Cl-�����������к��������ӣ����������軯����Һ���м��飬�����Һ��ΪѪ��ɫ��֤�������������ɣ�
��5��Fe3+�������������ܰѶ�����������Ϊ��������ӣ�������ԭΪFe2+������˵��������Fe3+��SO2����Ӧ�����ӷ���ʽΪ2Fe3++SO2+2H2O=2Fe2++4H++SO42-��
��6�����е�һ����Fe3+��Fe2+�������������Դ��������ӣ����еڶ��κ���SO42���������ǹ����������Ѷ�����������ΪSO42������һ����Fe3+�Ѷ��������������£��״������е�һ�μ���Fe3+����Fe2+��˵���������㣬���������Դ��������ӣ����еڶ��κ���SO42����˵�������˶��������������ӵķ�Ӧ�������������Ӵ��ڶ���������˿���֤��������Cl2��Fe3+��SO2������ȷ�����е�һ����Fe3+��Fe2+�������������Դ��������ӣ��ڶ�����Fe2+��˵�������˶��������������ӵķ�Ӧ���������������Ӵ��ڶ���������˿���֤��������Cl2��Fe3+��SO2������ȷ����ѡ�ҡ�����



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ƾ�����ǿɰ���ִ���������Լ�ʻԱ���ƵĶ��٣��乤��ԭ��ʾ��ͼ��ͼ��ʾ����Ӧԭ��Ϊ��CH3CH2OH+O2�TCH3COOH+H2O�������ߺ��������������ľƾ������͵�����з�Ӧ����С�������õ��������ӷŴ����Ŵ����Һ����ʾ������ʾ��ƾ�����������˵����ȷ���ǣ������� 
A.bΪ�������缫��ӦʽΪ��O2+4H++4e���T2H2O
B.�������Һ�е�H+����a�缫
C.����0.4 mol����ת�ƣ����ڱ�״��������4.48L����
D.���������оƾ�����Խ�ߣ���������ͨ���ĵ���ԽС
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y��Z��P��QΪǰ������Ԫ�أ���ԭ��������������X��̬ԭ�ӵ�L����3�������ӣ�Z�����ڱ��е縺������Ԫ�أ�Y��PΪͬ����Ԫ�أ���P��̬ԭ�ӵ�M�������ΪK���3����Q2+���ӵ�3d�������9�����ӡ��ش��������⡣
��1����̬Yԭ�ӵļ۵����Ų�ͼ��____��P���������е�һ��������������Ԫ����__________ ��Ԫ�����ƣ���
��2��XY3-�У�����ԭ�ӵ��ӻ���ʽΪ____________��XY2-���ӵ����幹����_______________��
��3��X ���⻯���Y���⻯��е�͵�ԭ����_________________________��
��4��X���⻯�����γ���λ������XZ3�����γ���λ����ԭ����_____________________��
��5��Y ��Q���γɵĻ����ᄃ�徧����ͼ��ʾ���þ���Ļ�ѧʽ��______________������������ͼ��ʾ����þ����ܶ���_______________g��cm-3������ʽ��������������С�����һλ����

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ͻ����������������������ѧ���е���ܡ������������ںϽ����
A. ��ͭ B. ���ʯ C. �뵼��� D. �մ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼΪԪ�����ڱ�ǰ�����ڵ�һ���֣������й�R��W��X��Y��Z����Ԫ�ص������У���ȷ���ǣ������� 
A.WԪ�صĵ�һ������С��YԪ�صĵ�һ������
B.Y��Z�������ӵ��Ӳ�ṹ����Rԭ�ӵ���ͬ
C.p�ܼ�δ�ɶԵ���������ZԪ��
D.XԪ���ǵ縺������Ԫ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������H2A��Һ��������H2A��HA-��A2-������̬�����ӣ������ʵ���������(X)����ҺpH�仯�Ĺ�ϵ��ͼ��ʾ[��֪��(X)=![]() ]������˵������ȷ����(ͼ����a=1.25��b=4.27)
]������˵������ȷ����(ͼ����a=1.25��b=4.27)
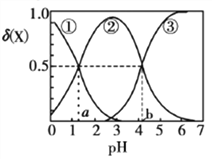
A. ��֪pKa=-lgKa����pKa1=1.25
B. 0.1mol��L-1��NaHA��Һ�Լ���
C. 0.1mol��L-1Na2A��Һ����2c(H2A)+c(HA-)=c(OH-)-c(H+)
D. 0.1mol��L-1NaHA��Һ����c(Na+)+c(A2-)+c(H2A)+c(HA-)=0.2mol��L-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������йػ�ѧ�����ʾ��ȷ���ǣ�������
A.K+�Ľṹʾ��ͼ�� ![]()
B.B����̬��ԭ�ӵĵ����Ų�ͼ ![]()
C.ˮ�ĵ���ʽ�� ![]()
D.D����̬��ԭ�ӣ�24Cr���ļ۵����Ų�ʽ��3d44s2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʯ���ͷֽ��ʵ��װ������ͼ��ʾ�����Թܢ��м���ʯ���ͺ����������Թܢڷ�����ˮ�У��Թܢ��м������Ը��������Һ���Թܢ��м�����ˮ��

�����ش��������⣺
(1)�Թܢ��м�����������������________________________________________________��
(2)�Թܢ��ڿ�����ʵ��������__________________________________________________��
(3)�Թܢ��п�����ʵ������Ϊ__________________________________________________��
(4)�Թܢ��п�����ʵ������Ϊ__________________________________________________��
(5)ͨ����ʵ��˵��____________________________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������к��зḻ�ĵ⡣Ϊ�˴Ӻ�������ȡ��,ij�о���ѧϰС����Ʋ�����������ʵ��:
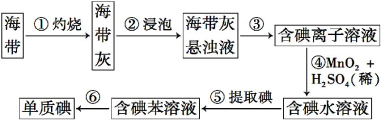
����д���пհ�:
��1�����������պ���ʱ,����Ҫ���ż���,����Ҫ�õ���ʵ��������_________��������������ѡ�����������,�ñ����ĸ��д�հ״�����
A.�ձ�
B.����
C.������
D.������
E.�ƾ���
F.������
��2����������ʵ����������� ;��������Ŀ���ǴӺ���ı���Һ�з�������ʵ�ͻ��ձ�,�ò����ʵ����������� ��
��3����������Ӧ�����ӷ���ʽ�� ��
��4����������,ijѧ��ѡ���ñ�����ȡ��������� ��
��5�������һ�ּ�����ȡ����ˮ��Һ���Ƿ��е��ʵ�ļ���: ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com