
| 1 |
| 2 |
| 1 |
| 8 |


科目:高中化学 来源: 题型:
| 实验步骤、预期现象 | 结论 |
| ①向溶液中加入适量四氯化碳, | 假设1正确 |
| ②向溶液中加入 | 假设2正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 时间/(min) | n(A)/( mol) | n(B)/( mol) | n(C)/( mol) |
| 0 | 1 | 3 | 0 |
| 第2 min | 0.8 | 2.6 | 0.4 |
| 第4 min | 0.4 | 1.8 | 1.2 |
| 第6 min | 0.4 | 1.8 | 1.2 |
| 第8 min | 0.1 | 2.0 | 1.8 |
| 第9 min | 0.05 | 1.9 | 0.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用聚氯乙烯塑料袋包装食品 |
| B、在食用盐中添加适量的碘酸钾 |
| C、在食品加工中科学使用食品添加剂 |
| D、研发高效低毒的农药,降低蔬菜的农药残留量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①② | B、①③ |
| C、②④ | D、①②⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:

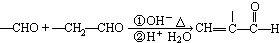

| NaCN |
| H+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、C2H6O和C4H10都有2种同分异构体 |
| B、在一定条件下,乙烯能与H2发生加成反应,苯不能与H2发生加成反应 |
| C、乙酸乙酯、乙酸均能与NaOH反应,二者分子中官能团相同 |
| D、乙醇和汽油都是可再生能源,应大力推广乙醇、汽油的使用 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com