
(1)将锌、铜用导线连接后浸入2mol/L的稀硫酸中,正极电极反应式为_____________________________,发生 反应(填氧化或还原);电子从 经外电路到 (填锌或铜),溶液中H+ 向 移动(填正极或负极)。
(2)根据反应2Fe3+ + Cu = 2Fe2++Cu2+ 设计原电池,所需负极材料为 ,溶液中Fe3+向 (填“负极”或“正极”)迁移,负极反应式为 ;正极反应式为 。
 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案科目:高中化学 来源: 题型:
有机物A、B、C、D有如下性质。
(1)具有支链的化合物A的分子式为C4H6O2,A可以使Br2的四氯化碳溶液褪色。1molA
和1mol NaHCO3能完全反应,则A的结构简式是 。
写出与A具有相同官能团的A的所有同分异构体的结构简式
。
(2)化合物B含有C、H、O三种元素,分子量为60,其中碳的质量分数为60%,氢的质量分数为13.33%。B在催化剂Cu的作用下被氧化成C,C能发生银镜反应,则B的结构简式是 。
(3)D在NaOH水溶液中加热反应,可生成A的钠盐和B,相应反应的化学方程式是
。
查看答案和解析>>
科目:高中化学 来源: 题型:
(10分)按下面步骤由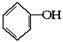 合成
合成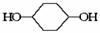 (部分试剂和反应条件已略去)。
(部分试剂和反应条件已略去)。

请回答下列问题:
(1)分别写出B、D的结构简式:B_________、D_________。
(2)反应①~⑦中属于消去反应的是 。(填数字序号)
(3)如果不考虑⑥、⑦反应,对于反应⑤,得到的E可能的结构简式为:
(4)试写出C→D反应的化学方程式(注明反应条件)
查看答案和解析>>
科目:高中化学 来源: 题型:
航天飞机用的铝粉与高氯酸铵(NH4ClO4)的混合物为固体燃料,点燃时铝粉氧化放热引发高氯酸铵反应,其方程式可表示为:2NH4ClO4  N2↑+ 4H2O+Cl2↑+2O2↑,放出热量为Q,下列对此反应叙述中错误的是( )
N2↑+ 4H2O+Cl2↑+2O2↑,放出热量为Q,下列对此反应叙述中错误的是( )
A. 反应属于分解反应
B. 上述反应瞬间产生大量高温气体推动航天飞机飞行
C. 反应从能量变化上说,主要是化学能转变为热能和动能
D. 在反应中高氯酸铵只起氧化剂作用
查看答案和解析>>
科目:高中化学 来源: 题型:
铜、锌和硫酸构成的原电池中,当导线中有1 mol电子通过时,理论上两极的变化是( )
①锌片溶解32.5 g ②锌片增重32.5 g ③铜片上析出1 g H2 ④铜片上析出1 mol H2
A.①③ B.①④ C.②③ D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
CO中混有C O2、H2S、HCl和水蒸气,
O2、H2S、HCl和水蒸气, 为了分别除去杂质气体
为了分别除去杂质气体 得到干燥、纯净的CO,操作步骤和顺序完全正确的是( )
得到干燥、纯净的CO,操作步骤和顺序完全正确的是( )
①通过装浓硫酸的洗气瓶
②通过装水的洗气瓶
③通过装NaOH溶液的洗气瓶
④通过灼热的CuO
⑤通过装CuSO4溶液的洗气瓶
⑥通过装P2O5的干燥管
A.①③④⑥ B.②⑤③①
C.②④③① D.①③⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示是学生课外活动小组设计的制取氨气并进行氨气溶于水的喷泉实验等实验的装置示意图。

请回答下列问题:
(1)学生甲用图A所示装置制备氨气,写出该法制取氨气的化学方程式_________________________________________________________________;
制出的氨气应使用________法来收集,要得到干燥的氨气可选用________做干燥剂。
(2)学生乙用图B所示装置也制出了氨气,他选用的制取试剂可能是________和_ _______。
_______。
(3)学生丙用图C所示装置进行喷泉实验,烧瓶内已充满干燥的氨气,引发水向上喷的操作是_________ ___________________________________________
___________________________________________
_____________________________________ ____________________________。
____________________________。
(4)学生丁将装置C误认为装置D,但经同学讨论后,认为也可引发喷泉。请说明用该装置引发喷泉的方法________________________________________
_________________________________________________________________。
(5)学生戊用装置E吸收一段时间氨后,再通入空气,同时将经过加热的铂丝插入E装置的锥形瓶内,看到了具有催化作用的铂丝保持红热,同时瓶内生成了红棕色的气体。写出在此过程中可能发生反应的化学方程式___________
_________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
铜锈是一种绿色化合物,它的成分为碱式碳酸铜,兼有氢氧化铜和碳酸铜的性质。试推测:铜锈在高温灼烧条件下充分反应后的固体物质是( )
A.黑色的氧化铜
B.红色的氧化亚铜
C.蓝色的氢氧化铜和碳酸铜
D.黑色的氧化亚铜
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应的离子方程式书写错误的是
A. 向氢氧化钠溶液中通入过 量二氧化碳:OH-+ CO2 = HCO3-
量二氧化碳:OH-+ CO2 = HCO3-
B. 澄清的石灰水与稀盐酸反应 Ca (OH)2 + 2H+ = Ca2++ 2H2O
C. 铁跟稀硫酸反应:Fe+2H+==Fe2++H2↑
D. 醋酸溶液跟氨水混合:CH3COOH+NH3·H2O = CH3COO-+NH4++H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com