
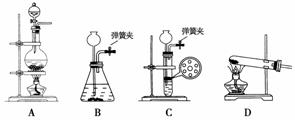
如图所示是学生课外活动小组设计的制取氨气并进行氨气溶于水的喷泉实验等实验的装置示意图。

请回答下列问题:
(1)学生甲用图A所示装置制备氨气,写出该法制取氨气的化学方程式_________________________________________________________________;
制出的氨气应使用________法来收集,要得到干燥的氨气可选用________做干燥剂。
(2)学生乙用图B所示装置也制出了氨气,他选用的制取试剂可能是________和_ _______。
_______。
(3)学生丙用图C所示装置进行喷泉实验,烧瓶内已充满干燥的氨气,引发水向上喷的操作是_________ ___________________________________________
___________________________________________
_____________________________________ ____________________________。
____________________________。
(4)学生丁将装置C误认为装置D,但经同学讨论后,认为也可引发喷泉。请说明用该装置引发喷泉的方法________________________________________
_________________________________________________________________。
(5)学生戊用装置E吸收一段时间氨后,再通入空气,同时将经过加热的铂丝插入E装置的锥形瓶内,看到了具有催化作用的铂丝保持红热,同时瓶内生成了红棕色的气体。写出在此过程中可能发生反应的化学方程式___________
_________________________________________________________________。
(1)A装置是固体和固体混合加热制备氨气的装置,应选用的试剂是NH4Cl和 Ca(OH)2固体。氨气极易溶于水,比空气密度小,要用向下排空气法收集。干燥氨气用碱石灰等碱性干燥剂。(2)B装置是固体和液体在不加热时反应制氨气的装置,可选用浓氨水和生石灰(或固体NaOH)混合反应。
Ca(OH)2固体。氨气极易溶于水,比空气密度小,要用向下排空气法收集。干燥氨气用碱石灰等碱性干燥剂。(2)B装置是固体和液体在不加热时反应制氨气的装置,可选用浓氨水和生石灰(或固体NaOH)混合反应。
(3)氨气极易溶于水,用C装置进行喷泉实验时,先要打开止水夹,然后挤压胶头滴管,使少量水进入烧瓶,氨 气溶于水导致烧瓶内压强急剧减小,外界大气压将烧杯内的水压入烧瓶即可形成喷泉。(4)对于装置D,可以设法使烧瓶受热,瓶内气体膨胀,排出玻璃导管中的空气,瓶内氨气与水接触即产生喷泉。(5)本实验的原理:氨在受热时被催化氧化为NO,NO与O2反应变成红棕色的NO2。
气溶于水导致烧瓶内压强急剧减小,外界大气压将烧杯内的水压入烧瓶即可形成喷泉。(4)对于装置D,可以设法使烧瓶受热,瓶内气体膨胀,排出玻璃导管中的空气,瓶内氨气与水接触即产生喷泉。(5)本实验的原理:氨在受热时被催化氧化为NO,NO与O2反应变成红棕色的NO2。
答案 (1)2NH4Cl+Ca(OH)2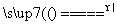 CaCl2+2NH3↑+2H2O 向下排空气 碱石灰(或氢氧化钠固体、氧化钙固体等) (2)氧化钙或固体氢氧化钠 浓氨水 (3)打开止水夹,挤出胶头滴管中的水 (4)打开止水夹,用手(或热毛巾等)将烧瓶捂热,氨气受热膨胀,赶出玻璃导管中的空气,氨气与水接触,即发生喷泉 (5)4NH3+5O2
CaCl2+2NH3↑+2H2O 向下排空气 碱石灰(或氢氧化钠固体、氧化钙固体等) (2)氧化钙或固体氢氧化钠 浓氨水 (3)打开止水夹,挤出胶头滴管中的水 (4)打开止水夹,用手(或热毛巾等)将烧瓶捂热,氨气受热膨胀,赶出玻璃导管中的空气,氨气与水接触,即发生喷泉 (5)4NH3+5O2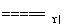 4NO+6H2O,2NO+O2===2NO2
4NO+6H2O,2NO+O2===2NO2


科目:高中化学 来源: 题型:
X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如图所示。若Y原子的最外层电子数是次外层电子数的3倍,下列说法中正确的是 ( )
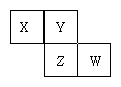 A.原子半径:W> Z>Y>X
A.原子半径:W> Z>Y>X
B.最高价氧化物对应水化物的酸性:Z>W>X
C.4种元素的单质中,Z单质的熔、沸点最低
D.W单质能与水反应,生成一种具有漂白性的物质
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)将锌、铜用导线连接后浸入2mol/L的稀硫酸中,正极电极反应式为_____________________________,发生 反应(填氧化或还原);电子从 经外电路到 (填锌或铜),溶液中H+ 向 移动(填正极或负极)。
(2)根据反应2Fe3+ + Cu = 2Fe2++Cu2+ 设计原电池,所需负极材料为 ,溶液中Fe3+向 (填“负极”或“正极”)迁移,负极反应式为 ;正极反应式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列除去杂质的方法不正确的是 ( )。
A.镁粉中混有少量铝粉:加入过量烧碱溶液充分反应,过滤、洗涤、干燥
B.用过量氨水除去Fe3+溶液中的少量Al3+
C.用新制的生石灰,通过加热蒸馏,以除去乙醇中的少量水
D.Al(OH)3中混有少量Mg(OH)2:加入足量烧碱溶液,充分反应,过滤,向滤液中通入过量CO2后过滤
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学兴趣小组用铝土矿(主要成分为Al2O3,还含有SiO2及铁的氧化物)提取氧化铝做冶炼铝的原料,提取的操作过程如下:
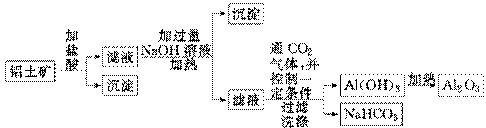
(1)实验室中制取CO2时,为了使反应随开随用、随关随停,应选用下图中的装置________(填字母代号)。
(2)在过滤操作中,除烧杯、玻璃棒外,还需用到的玻璃仪器有
________________________;洗涤沉淀的操作是
__________________ ______________________________________________________。
______________________________________________________。
(3)实验室制备氢氧化铝的方案有多种。现提供铝屑、氢氧化钠溶液、稀硫酸三种药品,若制备等量的氢氧化铝,请你从药品用量最少的角度出发,设计出最佳实验方案(方案不必给出),写出此方案中发生反应的离子方程式:
________________________________________________________________________
________________________________________________________________________。
此方案中所用药品的物质的量之比是:n(Al)∶n(H2SO4)∶n(NaOH)=________。
(4)兴趣小组欲对铝土矿中铁元素的价态进行探究:取少量固体,加入过量稀硝酸,加热溶解;取少许溶液滴加KSCN溶液后出现红色。由此得出,铁元素的价态为+3的结论。请指出该结论是否合理并说明理由______________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
硅及其化合物的应用范围很广。下列说法正确的是 ( )。
A.硅是人类将太阳能转换为电能的常用材料
B.粗硅制备单晶硅不涉及氧化还原反应
C.反应:Si+2NaOH+H2O===Na2SiO3+2H2↑中,Si为还原剂,NaOH和H2O为氧化剂
D.硅能与氢氟酸反应,则硅可以与盐酸反应
查看答案和解析>>
科目:高中化学 来源: 题型:
依据元素周期律及元素周期表知识,下列推断正确的是 ( )。
A.酸性:H2SiO3>H2CO3
B.热稳定性:H2Se>H2S>H2O
C.碱性:CsOH>Ca(OH)2
D.若离子半径:R2->M+,则原子序数:R>M
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com