
| A. | 生成白色沉淀 | B. | 有气泡产生,生成红褐色沉淀 | ||
| C. | 有气泡产生 | D. | 无变化 |
分析 Na2O2投入FeCl3溶液反应中Na2O2和水反应,生成的氢氧化钠和氧气,Fe3+与氢氧化钠反应,生成Fe(OH)3红褐色沉淀,以此解答该题.
解答 解:将Na2O2投入FeCl3溶液中,发生的反应为:2Na2O2+2H2O═4NaOH+O2↑,Fe3+与氢氧化钠反应,3OH-+Fe3+═Fe(OH)3↓,立即生成红褐色的Fe(OH)3沉淀,
所以看到的现象是:有大量气泡生成,有红褐色沉淀生成.
故选B.
点评 本题考查的是钠化合物的性质、氢氧化钠的性质与铁的化合物性质,为高频考点,侧重考查学生的分析能力,正确分析反应过程是解本题的关键,经常考查的还有Na2O2、Na投入CuSO4溶液中观察到的现象,难度不大.


 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:解答题
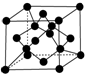 原子序数依次增大的X、Y、Z、G、Q、R、T七种元素,核电荷数均小于36.已知X的一种1:2型氢化物分子中既有σ键又有π键,且所有原子共平面;Z的L层上有2个未成对电子;Q原子的s能级与p能级电子数相等;R单质是制造各种计算机、微电子产品的核心材料;T处于周期表的ds区,原子中只有一个未成对电子.
原子序数依次增大的X、Y、Z、G、Q、R、T七种元素,核电荷数均小于36.已知X的一种1:2型氢化物分子中既有σ键又有π键,且所有原子共平面;Z的L层上有2个未成对电子;Q原子的s能级与p能级电子数相等;R单质是制造各种计算机、微电子产品的核心材料;T处于周期表的ds区,原子中只有一个未成对电子.| 氟化物 | G的氟化物 | Q的氟化物 | R的氟化物 |
| 熔点/K | 993 | 1 539 | 183 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 体积大小:③>②>① | B. | 原子数目:③>①>② | C. | 密度大小:②>③>① | D. | 质量大小:②>③>① |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 编号 | ① | ② | ③ | ④ |
| 装置 |  |  |  |  |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将NaOH浓溶液滴加到饱和FeCl3溶液中制备Fe(OH)3胶体 | |
| B. | 用向上排空气法收集铜粉与稀硝酸反应产生的NO | |
| C. | 配制氯化铁溶液时,将氯化铁溶解在较浓的盐酸中再加水稀释 | |
| D. | 将Cl2与HCl混合气体通过饱和食盐水可得到纯净的Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
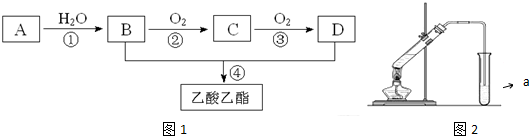
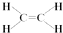 ,C的结构简式:CH3CHO.
,C的结构简式:CH3CHO.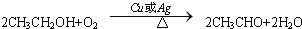 ;反应类型:氧化反应.
;反应类型:氧化反应.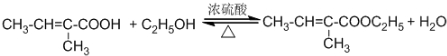 ,为从该实验后的混合气体中分离出乙酸乙酯,右侧试管中所选用的试剂a是饱和碳酸钠溶液,a试剂的作用是中和乙酸、吸收乙醇、降低乙酸乙酯在溶液中的溶解度,有利于分层析出.
,为从该实验后的混合气体中分离出乙酸乙酯,右侧试管中所选用的试剂a是饱和碳酸钠溶液,a试剂的作用是中和乙酸、吸收乙醇、降低乙酸乙酯在溶液中的溶解度,有利于分层析出.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com