
分析 主族元素A、B、C、D的原子序数都小于18,C最外层电子数是次外层电子数的2倍,则C元素原子有2个电子层,最外层电子数为4,则C为C元素;B与C在同一周期,C原子最外层电子数比B原子少2个,则B元素原子最外层电子数为6,则B为O元素;A与D同主族,A、D原子的最外层电子数都是1,处于ⅠA族,A单质在常温下为气体,则A为H元素;氢气与氧气在高温下以体积比2:1完全反应,生成物在常温下是液体为H2O;水与D单质能激烈反应生成A的单质,所得溶液滴入酚酞显红色,同时溶液中含有与氖原子的电子层结构相同的阳离子,则D为Na元素,以此来解答.
解答 解:主族元素A、B、C、D的原子序数都小于18,C最外层电子数是次外层电子数的2倍,则C元素原子有2个电子层,最外层电子数为4,则C为碳元素;B与C在同一周期,C原子最外层电子数比B原子少2个,则B元素原子最外层电子数为6,则B为氧元素;A与D同主族,A、D原子的最外层电子数都是1,处于ⅠA族,A单质在常温下为气体,则A为氢元素,氢气与氧气在高温下以体积比2:1完全反应,生成物在常温下是液体为H2O,水与D单质能激烈反应生成A的单质,所得溶液滴入酚酞显红色,同时溶液中含有与氖原子的电子层结构相同的阳离子,则D为Na元素,
(1)由上述分析可知,A为H,B为O,C为C,D为Na,
故答案为:H;O;C;Na;
(2)B、D在加热条件下形成化合物为Na2O2,其电子式为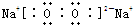 ,含有的化学键为:离子键、非极性共价键,
,含有的化学键为:离子键、非极性共价键,
故答案为:离子键、非极性共价键;
(3)H、O、C、Na四种元素可以形成化合物碳酸氢钠,其化学式为NaHCO3,
故答案为:NaHCO3.
点评 本题考查结构性质位置关系,为高频考点,把握原子的电子排布、元素化合物性质推断元素为解答的关键,侧重分析与推断能力及常见化学用语的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
 如表各组物质中,不能通过一步反应实现如图所示转化的是( )
如表各组物质中,不能通过一步反应实现如图所示转化的是( )| 选项 | X | Y | Z |
| A | Fe | FeCl3 | FeCl2 |
| B | NH4Cl | NH3 | NO |
| C | C | CO | CO2 |
| D | Al2O3 | AlCl3 | Al(OH)3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | [Cr(H2O)6]Cl3 | B. | [Cr(H2O)5Cl]Cl2•H2O | ||
| C. | [Cr(H2O)4Cl2]Cl•2H2O | D. | [Cr(H2O)3Cl3]•3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 所用的酸过量 | B. | 生成的盐不水解 | ||
| C. | 酸与碱等物质的量混合 | D. | 反应后溶液中c(A-)=c(M+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (用电子式表示).
(用电子式表示).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④ | B. | ②③④⑥ | C. | ①②④⑤ | D. | ①②③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝热反应是冶炼难熔金属的方法之一 | |
| B. | 铝热剂是混合物 | |
| C. | 活泼金属的冶炼常用电解方法,如电解NaCl溶液就可制备Na | |
| D. | 湿法炼铜的原理是 Fe+CuSO4=Cu+FeSO4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com