
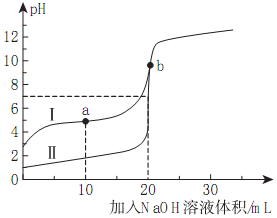
 室温下,用0.10mol/LNaOH溶液分别滴定20.00mL0.10mol/L的HA和HB溶液,滴定曲线如图所示.下列说法错误的是( )
室温下,用0.10mol/LNaOH溶液分别滴定20.00mL0.10mol/L的HA和HB溶液,滴定曲线如图所示.下列说法错误的是( )| A. | 若Ⅰ代表HB,加入20mLNaOH后溶液中:c(B-)+c(HB)=0.05mol/L | |
| B. | 若V(NaOH)=20.00mL时,NaB溶液呈碱性,NaA呈中性则HA是强酸 | |
| C. | a点时的溶液中离子浓度最大的离子是Na+ | |
| D. | 若Ⅱ代表HA的滴定曲线,则Ka(HB)≈10-5 |
分析 A.当Ⅰ代表HB,0.1mol/L溶液中氢离子浓度小于0.1mol/L,是弱酸,结合物料守恒分析;
B.若V(NaOH)=20.00mL时,与HA的体积、浓度相同,二者完全反应,NaA呈中性,则HA是强酸;
C.a点时的溶液中溶质是等物质的量的NaB和HB,溶液显酸性;
D.a点时的溶液中溶质是等物质的量的NaB和HB,溶液的pH=5,根据ka(HB)=$\frac{c({H}^{+})•c({B}^{-})}{c(HB)}$计算.
解答 解:A.当Ⅰ代表HB,0.1mol/L溶液中氢离子浓度小于0.1mol/L,是弱酸,b点时体系中有,体积变为原来的2倍,则浓度变为原来的二分之一,所以c(B-)+c(HB)=0.05mol/L,故A正确;
B.若V(NaOH)=20.00mL时,与HA的体积、浓度相同,二者完全反应,NaA呈中性,可说明HA是强酸,故B正确;
C.a点时的溶液中溶质是等物质的量的NaB和HB,溶液显酸性,则c(Na+)<c(B-),故C错误;
D.a点时的溶液中溶质是等物质的量的NaB和HB,则溶液中c(HB)≈c(B-),溶液的pH=5,c(H+)=10-5mol/L,Ka(HB)=$\frac{c({H}^{+})•c({B}^{-})}{c(HB)}$≈10-5,故D正确.
故选C.
点评 本题考查了酸碱混合溶液定性判断,为高频考点,题目涉及弱电解质的电离、盐类水解、酸碱中和反应等知识点,根据弱电解质的电离特点、溶液酸碱性及盐类水解等知识点来分析解答,题目难度中等.


 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案科目:高中化学 来源: 题型:实验题
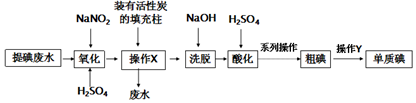
 请回答:
请回答:查看答案和解析>>
科目:高中化学 来源: 题型:多选题
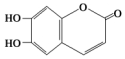 ,下列叙述正确的是( )
,下列叙述正确的是( )| A. | M的分子式为C9H6O4 | |
| B. | 1 mol M最多能与2 mol Br2发生反应 | |
| C. | 1 molM最多能与4 mol氢氧化钠反应 | |
| D. | M既可以与FeCl3溶液发生显色反应,又可以与NaHCO3溶液反应放出CO2气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O(l)?H+(aq)+OH-(aq)△H<0 | |
| B. | 纯液态水中,一定存在Kw=[H+][OH-] | |
| C. | 纯液态水中,一定存在[H+][OH-]=1×10-14mol2•L-2 | |
| D. | 25℃,[H+]=1×10-7mol•L-1的液体一定是纯水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  分离碘和酒精 | B. | 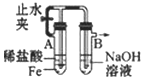 较长时间观察Fe(OH)2白色沉淀 | ||
| C. | 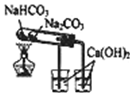 验证NaHCO3和Na2CO3的热稳定性 | D. | 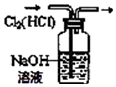 除去Cl2中HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com