
分析 (1)碳酸为二元弱酸,碳酸氢钠为其酸式盐,在水中完全电离出钠离子和碳酸氢根离子;
(2)HNO3和Ba(OH)2发生复分解反应生成硝酸钡和水;
(3)氧化铝为两性物质既能与强酸又能与强碱反应生成盐和水;硝酸与强酸不反应;碳酸氢钠与强酸反应生成盐和二氧化碳和水;与强碱反应生成碳酸盐和水;氢氧化钡与强碱不反应.
解答 解:(1)碳酸氢钠在水中电离出钠离子和碳酸氢根离子,电离方程式为:NaHCO3═Na++HCO3-,
故答案为:NaHCO3═Na++HCO3-;
(2)HNO3为一元强酸,Ba(OH)2为二元强碱,两者混合生成硝酸钡和水,反应的离子方程式为:H++OH-=H2O,
故答案为:H++OH-=H2O;
(3)氧化铝为两性物质既能与强酸又能与强碱反应生成盐和水;如氧化铝与盐酸反应生成氯化铝和水,方程方程式为:Al2O3+6HCl=2AlCl3+3H2O;
氧化铝与氢氧化钠生成偏铝酸钠和水,方程方程式为:Al2O3+2NaOH═2NaAlO2+H2O;
硝酸与强酸不反应;
碳酸氢钠与强酸反应生成盐和二氧化碳和水;如碳酸氢钠与盐酸反应生成氯化钠、水和二氧化碳,反应的方程式为HCl+NaHCO3=NaCl+H2O+CO2↑,与强碱反应生成碳酸盐和水,如碳酸氢钠与氢氧化钠反应生成碳酸钠、水,反应的方程式为NaOH+NaHCO3=Na2CO3+H2O,
氢氧化钡与强碱不反应;
所以既能与强酸反应,又能与强碱反应的物质是①③;
故答案为:①③.
点评 本题考查了电解质电离方程式书写、离子方程式的书写、元素化合物性质,明确反应实质及物质的性质是解题关键,题目难度不大.


 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 当b≤a时,发生的离子方程式:H2S+Cl2=2H++S↓+2Cl- | |
| B. | 当2a=b时,发生的离子方程式:3H2S+6Cl2+4H2O=14H++2S↓+SO42-+12Cl- | |
| C. | 当a≤b≤4a时,反应中转移电子的物质的量n(e-)为2amol≤n(e-)≤8amol | |
| D. | 当a<b<4a时,溶液中的S、SO42-、Cl-的物质的量比为(4a-b):(b-a):2b |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
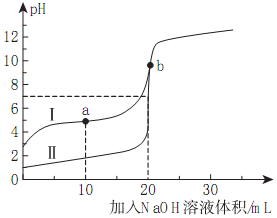 室温下,用0.10mol/LNaOH溶液分别滴定20.00mL0.10mol/L的HA和HB溶液,滴定曲线如图所示.下列说法错误的是( )
室温下,用0.10mol/LNaOH溶液分别滴定20.00mL0.10mol/L的HA和HB溶液,滴定曲线如图所示.下列说法错误的是( )| A. | 若Ⅰ代表HB,加入20mLNaOH后溶液中:c(B-)+c(HB)=0.05mol/L | |
| B. | 若V(NaOH)=20.00mL时,NaB溶液呈碱性,NaA呈中性则HA是强酸 | |
| C. | a点时的溶液中离子浓度最大的离子是Na+ | |
| D. | 若Ⅱ代表HA的滴定曲线,则Ka(HB)≈10-5 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,任何气体的摩尔体积都是22.4L | |
| B. | 11.2LCO2中含11NA个电子 | |
| C. | 标况下,NA个水分子所占的体积约为22.4L | |
| D. | 4℃时,18mL水和32gO2所含分子数均为1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 该反应中转移电子数目为6e | B. | KCl中含有37Cl | ||
| C. | Cl2中只含有37Cl | D. | 生成的氯气式量全为72 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
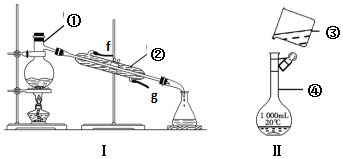
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com