
【题目】能证明硫元素的非金属性弱于氯元素的事实是( )
A. 通常情况下硫为浅黄色固体,而氯气为黄绿色的气体
B. 硫不溶于水而氯气溶于水
C. 跟金属或氢气反应时,硫被还原为![]() 价,而氯被还原为
价,而氯被还原为![]() 价
价
D. 跟Cu或Fe反应时,金属被硫氧化成低价态,而被氯气氧化成高价态
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列表示物质结构的化学用语正确的是 ( )
A. HF的电子式: ![]() B. HClO的结构式:H—O—Cl
B. HClO的结构式:H—O—Cl
C. S2-的结构示意图:![]() D. CaO的俗名:熟石灰
D. CaO的俗名:熟石灰
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中进行反应:X2(g)+Y2(g)![]() 2Z(g),已知的起始浓度分别为0.1mol/L、0.3 mol/L、 0.2 mol/L,在一定条件下,当反应达到平衡时,各物质的浓度可能是( )
2Z(g),已知的起始浓度分别为0.1mol/L、0.3 mol/L、 0.2 mol/L,在一定条件下,当反应达到平衡时,各物质的浓度可能是( )
A. c(Z)=0.3 mol/L B. c(X2)=0.2mol/L、
C. c(Y2)=0.4 mol/L D. c(X2)+ c(Y2) +c(Z)=0.55 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘可用作心脏起搏器电源——锂碘电池的材料。该电池反应为:2Li+I2=2LiI,下列说法正确的是( )
A.Li做负极,被还原B.I2做正极,被氧化
C.H2O作电解质D.电子由Li电极流出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】50mL浓硫酸和铜片加热后反应,铜片完全溶解后测得产生4.48L(标况下)气体,把反应后的溶液稀释至1L,取20mL溶液加入足量BaCl2溶液产生3.262g沉淀,求原硫酸溶液的物质的量浓度是多少______?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】50 mL 0.5 molL -1 盐酸与50 mL0.55 mol L -1 NaOH溶液在如下图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热,回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃用品是______________________。
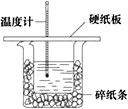
(2)烧杯间填满碎纸条的作用是______________________________________。
(3)若大烧杯上不盖硬纸板,求得中和热数值_______(填“偏大”“偏小”或“无影响”)。
(4)实验中改用60 mL 0.50 molL -1 盐酸跟50 mL 0.55 molL -1 NaOH溶液进行反应,与上述实验相比,所放出的热量 _______(填“相等”或“不相等”),所求中和热 _____(填“相等”或“不相等”),简述理由_______________________________。
(5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得中和热的数值会_________;用0.50 molL -1 NaOH溶液50 mL进行上述实验,测得的中和热的数值会__________(填“偏大”“偏小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国沿海某城市采用反渗透法将海水淡化,得到淡水供市民使用,剩余母液继续加工获得其他产品。母液中主要含有Cl-、Na+、K+、Mg2+ 、Ca2+、SO42-、Br-等离子。某实验小组同学模拟工业生产流程,进行如下实验。

(1)写出实验室制备氯气的化学方程式___________;
(2)海水淡化的方法还有____________(写出一种);
(3)I中,电解饱和食盐水的工业生产叫做氯碱工业,写出该反应的离子方程式____;
(4)II中的离子反应方程式________;Ⅲ中,加入适量CaCl2固体的目的是_____________________;
(5)写出IV中反应的离子方程式______________;
(6)与过程II类似,工业上常用“空气吹出法”实现海水提溴,将1m3海水浓缩至1L,使用该法最终得到36g Br2,若提取率为60%,则原海水中溴的浓度为_________ mg/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)常温下,2L pH=12的Ba(OH)2溶液的物质的量浓度为________,从中取出10mL加水稀释到100mL,pH=______。
(2)已知500mLAl2(SO4)3溶液中含有Al3+为0.5mol,则Al2(SO4)3溶液的物质的量浓度为____mol/L,取上述溶液50mL加水到150mL,此溶液中SO42-的物质的量浓度为_____mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,将一定量的气体通入体积为2 L的密闭容器中,使其发生反应,有关物质X、Y、Z的物质的量的变化如图所示。则下列有关推断正确的是( )

A. 该反应的化学方程式为:3Z![]() 2X+3Y
2X+3Y
B. t0时,反应停止,反应速率为0
C. t0时,Z的浓度为1.2 mol/L
D. t0时,X、Y、Z的质量不再改变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com