
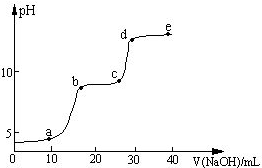
 某温度下,体积和pH都相同的盐酸和氯化铵溶液加水稀释时,pH变化曲线如图所示,下列判断正确的是( )
某温度下,体积和pH都相同的盐酸和氯化铵溶液加水稀释时,pH变化曲线如图所示,下列判断正确的是( )| A、a、c两点溶液的导电能力相同 |
| B、a、b、c三点溶液中水的电离程度:a>b=c |
| C、用等浓度的NaOH溶液分别与等体积的b、c两点溶液恰好完全反应,消耗NaOH溶液的体积相等 |
| D、b点溶液中存在微粒浓度关系:c(H+)=c(OH-)+c(NH3?H2O) |


 优加精卷系列答案
优加精卷系列答案科目:高中化学 来源: 题型:
 某研究性学习小组拟探究在含Mg2+、Al3+的混合溶液中滴加NaOH溶液时,生成氢氧化物沉淀的过程.
某研究性学习小组拟探究在含Mg2+、Al3+的混合溶液中滴加NaOH溶液时,生成氢氧化物沉淀的过程.| 较大量存在的含金属元素的离子 | 检验方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溶液中可能存在Al3+ |
| B、溶液中可能存在Br- |
| C、溶液中一定存在CO32- |
| D、溶液可能存在Ba2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向某溶液中加入氯化钡溶液,产生白色沉淀,过滤后向溶液中加入硝酸银溶液,有白色沉淀生成,则原溶液中一定有Cl-和SO42- |
| B、向某溶液中加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,则原溶液中一定有SO42- |
| C、向某溶液中加入AgNO3溶液,生成白色沉淀,该溶液中不一定含有Cl- |
| D、向某溶液中加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,则原溶液中一定有Ca2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
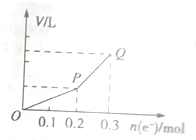 用惰性电极电解硫酸铜溶液,整个过程转移电子的物质的量与产生气体总体积的关系如图所示(气体体积均在相同状况下测定).欲使溶液恢复到起始状态,可向溶液中加入( )
用惰性电极电解硫酸铜溶液,整个过程转移电子的物质的量与产生气体总体积的关系如图所示(气体体积均在相同状况下测定).欲使溶液恢复到起始状态,可向溶液中加入( )| A、0.1molCuO |
| B、0.1molCuCO3 |
| C、0.1molCu(OH)2 |
| D、0.05molCu2(OH)2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③⑤ | B、③②⑥ |
| C、②④ | D、①④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、平衡向正反应方向移动 |
| B、混合气体的平均摩尔质量增大 |
| C、CO2的转化率增大 |
| D、逆反应速率减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 “天宫一号”的供电系统(RFC)是一种将水电解技术与氢氧燃料电池技术相结合的可充放电池.如图为RFC工作原理示意图.
“天宫一号”的供电系统(RFC)是一种将水电解技术与氢氧燃料电池技术相结合的可充放电池.如图为RFC工作原理示意图.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com