
将0.4gNaOH和1.06g Na2CO3混合并配成溶液,向溶液中滴加0.1mol·L-1稀盐酸。下列图像能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是
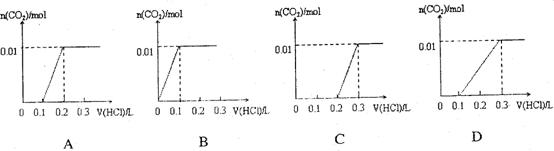

【答案】C
【解析】此题考查了元素化合物、图像数据的处理知识。向NaOH和Na2CO3混合溶液中滴加盐酸时,首先和NaOH反应生成水和氯化钠,当滴入0.1L时,两者恰好反应完全;继续滴加时,盐酸和Na2CO3开始反应,首先发生:HCl+ Na2CO3= NaHCO3+NaCl,不放出气体,当再加入0.1L时,此步反应进行完全;继续滴加时,发生反应:NaHCO3+HCl =NaCl+H2O+CO2↑;此时开始放出气体,分析图像,可知选C。
易错警示:解答此题的易错点是,不能准确理解向碳酸钠溶液中滴加盐酸的反应。是分步进行的,首先发生的是HCl+ Na2CO3= NaHCO3+NaCl;进行完全后,再发生:NaHCO3+HCl =NaCl+H2O+CO2↑



科目:高中化学 来源: 题型:
某化学兴趣小组的探究实验表明,二氧化碳与一氧化碳的性质有很大的不同。对这一
结论的原因解释比较合理的是( )
A. 一氧化碳有毒,二氧化碳无毒
B. 一氧化碳有还原性,二氧化碳无 还原性
还原性
C. 一氧化碳不溶于水,二氧化碳能溶于水
D. 1个CO分子比一个CO2分子少一个氧原子
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是
A.Li在氧气中燃烧主要生成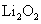
B.将SO2通入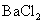 溶液可生成
溶液可生成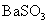 沉淀
沉淀
C.将CO2通入次氯酸钙溶液可生成次氯酸
D.将NH3通入热的CuSO4溶液中能使Cu2+还原成Cu

查看答案和解析>>
科目:高中化学 来源: 题型:
碳酸锂广泛应用于陶瓷和医药等领域。以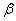 -锂辉石(主要成分为Li2O
-锂辉石(主要成分为Li2O Al2O3
Al2O3 4SiO2)为原材料制备Li2CO3的工艺流程如下:
4SiO2)为原材料制备Li2CO3的工艺流程如下:

已知:Fe3+、Al3+、Fe2+和Mg2+以氢氧化物形式完全沉淀时,溶液的PH分别为3.2、5.2、9.7和12.4;Li2SO4、LiOH和Li2CO3在303K下的溶解度分别为34.2g、12.7g和1.3g.
(1)步骤Ⅰ前, -锂辉石要粉碎成细颗粒的目的是_____________.
-锂辉石要粉碎成细颗粒的目的是_____________.
(2)步骤Ⅰ中,酸浸后得到的酸性溶液中含有Li+、SO42-,另含有Al3+、Fe3+、Fe2+、Mg2+、Ca2+、Na+等杂质,需在搅拌下加入_____________(填“石灰石”、“氯化钙”或“稀硫酸”)以调节溶液的PH到6.0~6.5,沉淀部分杂质离子,然后分离得到浸出液。
(3)步骤Ⅱ中,将适量的H2O2溶液、石灰乳和Na2CO3溶液依次加入浸出液中,可除去的杂质金属离子有______________.
(4)步骤Ⅲ中,生成沉淀的离子方程式为________________.
(5)从母液中可回收的主要物质是_____________.

查看答案和解析>>
科目:高中化学 来源: 题型:
金属铝的生产是以Al2O3为原料,在熔融状态下进行电解:2Al2O3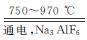 4Al+3O2↑
4Al+3O2↑
请回答下列问题:
(1)冰晶石(Na3AlF6)的作用是___________________。
(2)电解生成的金属铝是在熔融液的______________(填“上层”或“下层”)。
(3)阴极和阳极均由______________材料做成;电解时不断消耗的电极是___________(填“阳极”或“阴极”)。
(4)铝是高耗能产品,废旧铝材的回收利用十分重要。在工业上,最能体现节能减排思想的是将回收铝做成______________(填代号)。
a.冰晶石 b.氧化铝 c.铝锭 d.硫酸铝

查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,下列各组物质中,Y既能与X反应又能与Z反应的是( )
| X | Y | Z | |
| ① | NaOH溶液 | Al(OH)3 | 稀硫酸 |
| ② | KOH溶液 | SiO2 | 浓盐酸 |
| ③ | O2 | N2 | H2 |
| ④ | FeCl3溶液 | Cu | 浓硝酸 |
A.①③ B.①④ C.②④ D.②③
查看答案和解析>>
科目:高中化学 来源: 题型:
铝是一种应用广泛的金属,工业上用Al2O3和冰晶石(Na3AlF6)混合熔融电解制得。
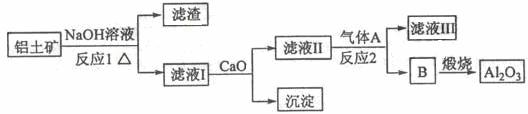
①铝土矿的主要成分是Al2O3和SiO2等。从铝土矿中提炼Al2O3的流程如下:
②以萤石(CaF2)和纯碱为原料制备冰晶石的流程如下:

回答下列问题:
(1)写出反应1的化学方程式 ;
(2)滤液Ⅰ中加入CaO生成的沉淀是 ,反应2的离子方程式为 ;
(3)E可作为建筑材料,化合物C是 ,写出由D制备冰晶石的化学方程式 ;
(4)电解制铝的化学方程式是 ,以石墨为电极,阳极产生的混合气体的成分是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com