
【题目】磺酰氯(SO2Cl2)是一种重要的有机合成试剂,实验室可利用SO2与Cl2在活性炭作用下反应制取少量的SO2Cl2,装置如下图所示(有些夹持装置省略)。已知SO2Cl2的熔点为-54.1 ℃,沸点为69.1 ℃,遇水能发生剧烈的水解反应,并产生白雾。
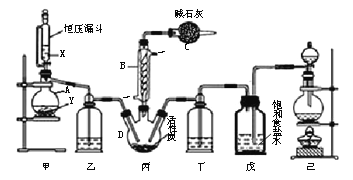
(1)单独检验己装置气密性的方法是:_______。
(2)由仪器B的使用可知SO2与Cl2反应的ΔH_______0(填“>”或“<”),仪器C的作用是_______。
(3)试剂X、Y的组合最好是________。
a.18.4 mol/L H2SO4+Cu b.4 mol/L HNO3+Na2SO3 c.60% H2SO4+K2SO3
(4)反应结束后,将丙中产物分离的实验操作是_______。
(5)分离产物后,向获得的SO2Cl2中加入足量NaOH溶液,振荡、静止得到无色溶液w。
①写出该反应的离子方程式:________;
②检验溶液w中存在Cl-的方法是________。
(6)SO2Cl2可以作为锂离子电池的正极活性材质,已知电池反应为:2Li+SO2Cl2=2LiCl +SO2↑。则电池工作时,正极的电极反应式为_________。
【答案】 关闭分液漏斗活塞,将导管末端插入水中,加热烧瓶,导管口有气泡产生,停止加热,导管内形成一段高于液面的稳定水注,则气密性好 < 吸收尾气Cl2、SO2,防止环境污染,同时防止空气中的水蒸气进入引起磺酰氯水解 c 蒸馏 SO2Cl2+4OH-=2Cl-+SO42-+2H2O 取少量w于试管中,加入足量Ba(NO3)2溶液,静置,向上层清液加入硝酸酸化的AgNO3溶液,有白色沉淀生成,则w中存在Cl- SO2Cl2+2e-=SO2↑+2Cl-
【解析】(1)检验己装置气密性的方法是:关闭分液漏斗活塞,将导管末端插入水中,加热烧瓶,导管口有气泡产生,停止加热,导管内形成一段高于液面的稳定水注,则气密性好;
(2)根据装置图可知,蛇形冷凝管的作用是冷凝回流而反应又没有加热,故SO2与氯气间的反应为放热反应,由于会有一部分Cl2、SO2通过冷凝管逸出,故C中应使用碱性试剂,又因SO2Cl2遇水易水解,故碱石灰是用于吸收氯气、SO2并防止空气中的水蒸气进入B中;
(3)甲是制备SO2的装置,铜与浓硫酸反应需要加热,硝酸能氧化SO2,所以用c.60%H2SO4+K2SO3来制备SO2,故选c;
(4)分离沸点不同的液体可以用蒸馏的方法,所以丙中混合物分离开的实验操作是蒸馏;
(5)①SO2Cl2中加入足量NaOH溶液,使之水解,所得溶液中含有SO42-和Cl-,发生反应的离子方程式为SO2Cl2+4OH-=2Cl-+SO42-+2H2O;
②取少量w于试管中,加入足量Ba(NO3)2溶液,静置,向上层清液加入硝酸酸化的AgNO3溶液,有白色沉淀生成,则w中存在Cl-;
(6)正极是SO2Cl2中+6价的硫得电子发生还原反应,所以电极反应式为:SO2Cl2+2e-=2Cl-+SO2↑。


 孟建平错题本系列答案
孟建平错题本系列答案 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案科目:高中化学 来源: 题型:
【题目】碱式碳酸镁可用于牙膏、医药化妆品等工业,化学式为4MgCO3·Mg(OH)2·5H2O,某碱式碳酸镁中含有SiO2杂质,为测定其纯度。某兴趣小组设计了如下几个方案:
方案1
取一定质量的样品,与硫酸充分反应,通过测定CO2的质量计算纯度

(1)乙中发生反应的方程式为______________________________ 。
(2)仪器接口的连接顺序为(装置可以重复使用) a___________,丁的作用是__________________。
(3)关闭止水夹K,向样品中加入足量的稀硫酸,当样品充分反应完后,为了测定准确还应进行的操作是______________________________。
方案Ⅱ
①称取碱式碳酸镁样品mg;②将样品充分高温燃烧,冷却后称量;③重复操作②,测得剩余固体质量为m1g(用托盘天平称量)。
(4)下列仪器中,该方案不会用到的是____________。

(5)判断样品完全分解的方法是_________________________。
(6)有同学认为方案Ⅱ高温燃烧的过程中会发生![]()
会导致测定结果有误,你任为这位同学的观点正确吗?_________,(填“正确”或“错误”)
请说明自己的理由:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在强酸性溶液中,下列离子组能大量共存且溶液为无色透明的是
A. Na+、K+、OH-、Cl- B.Na+、Cu2+、SO42-、NO3-
C.Mg2+、Na+、SO42-、Cl- D.Ca2+、HCO3-、NO3-、K+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用VSEPR模型预测下列分子或离子的立体结构,其中正确的是 ( )
A. H2O与BeCl2为角形(V形) B. CS2与SO2为直线形
C. SO3与CO![]() 为平面三角形 D. BF3与PCl3为三角锥形
为平面三角形 D. BF3与PCl3为三角锥形
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知3.6 g碳在6.4 g的氧气中燃烧,至反应物耗尽,并放出X kJ热量。已知单质C(s)的燃烧热为Y kJ/mol,则1 mol C(s)与O2(g)反应生成CO(g)的反应热ΔH为( )
A.-Y kJ/mol B.-(10X-Y)kJ/mol
C.-(5X-0.5Y) kJ/mol D.+(10X-Y)kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质无论以何种比例混合,只要总的物质的量一定,完全燃烧时消耗氧气的量为定值的是( )
A. CH2O、C2H4O2、C6H12O6
B. CH2= CH2,C2H5OH、HOCH2CH2COOH
C. C6H6O、C5H10、C7H6O2
D. H2、CO、CH3OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯是一种重要的化工原料,以乙烯为原料生产部分化工产品的反应如下(部分反应条件已略去):
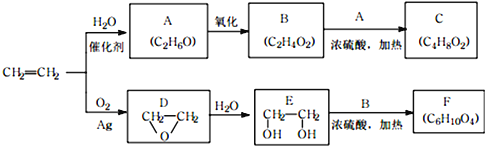
请回答下列问题:
(1)A的名称是___________,含有的官能团名称是_______________。
实验室由A转化为乙烯的反应条件为_______________。
(2)B和A反应生成C的化学方程式为_______________,该反应的类型为_______________。
(3)F的结构简式为__________________。
(4)写出D的同分异构体的结构简式__________________。
(5)乙炔是常见的一种化工原料,它可以制取很多化工产品。例如:聚氯乙烯塑料。写出由乙炔合成聚氯乙烯的合成路线。_____________
(合成路线常用的表示方式为:![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z三种短周期元素,原子半径的大小关系为:r(y)>r(x)>r(z),原子序数之和为16。X、Y、Z三种元素的常见单质在适当条件下可发生下图所示变化,其中B和C均为10电子分子。下列说法不正确的是

A. X元素位于ⅥA
B. A不能溶解于B中
C. B的沸点高于C的沸点
D. A和C不可能发生氧化还原反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com