
【题目】常温下,向某浓度的H2C2O4溶液中逐滴加入已知浓度的NaOH溶液,若定义pc是溶液中溶质的物质的量浓度的负对数,则所得溶液中pc(H2C2O4)、pc(HC2O4-)、pc(C2O42-)与溶液pH的关系如图所示(已知:H2C2O4HC2O4-+H+ Ka1;HC2O4- C2O42-)+H+ Ka2)。则下列说法正确的是( )

A.pH=4时,c(HC2O4-)<c(C2O42-)
B.常温下,Ka1=10-0.7
C.pH=3~5.3的过程中水的电离程度增大
D.常温下,![]() 随pH的升高先增大后减小
随pH的升高先增大后减小
【答案】C
【解析】
若定义pc是溶液中溶质的物质的量浓度的负对数,浓度越大,pc越小,因此曲线I为pc(HC2O4-),曲线II为pc(H2C2O4),曲线III为pc(C2O42-)。
A. 根据分析,曲线I为pc(HC2O4-),曲线III为pc(C2O42-),当pH=4时,pc越小,浓度越大,根据图得出c(C2O42-) < c(HC2O4-),故A错误;
B. 常温下,再a点,c(H2C2O4)和c(HC2O4-)浓度相等,因此Ka1= c(H+) = 10-0.8,故B错误;
C. pH=3~5.3的过程不断加入碱,溶液酸性减弱,抑制水的电离程度减弱,水的电离程度增大,故C正确;
D. 常温下,![]() 随pH的升高而不变,故D错误。
随pH的升高而不变,故D错误。
综上所述,答案为C。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】![]() 是制备电池的重要原料。室温下,
是制备电池的重要原料。室温下,![]() 溶液的pH随
溶液的pH随![]() 的变化如图甲所示,
的变化如图甲所示,![]() 溶液中
溶液中![]() 的分布分数
的分布分数![]() 随pH的变化如图乙所示
随pH的变化如图乙所示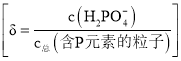 。
。
下列有关![]() 溶液的叙述正确的是
溶液的叙述正确的是 ![]()
![]()
A.溶液中存在3个平衡
B.含P元素的粒子有![]() 、
、![]() 和
和![]()
C.随![]() 增大,溶液的pH明显变小
增大,溶液的pH明显变小
D.用浓度大于![]() 的
的![]() 溶液溶解
溶液溶解![]() ,当pH达到
,当pH达到![]() 时,
时,![]() 几乎全部转化为
几乎全部转化为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烷的分子结构可简写成键线式结构![]() ,有机物A的键线式结构为
,有机物A的键线式结构为![]() ,有机物B与等物质的量的H2发生加成反应可得到有机物A。下列有关说法错误的是( )
,有机物B与等物质的量的H2发生加成反应可得到有机物A。下列有关说法错误的是( )
A.有机物A的一氯取代物只有4种
B.用系统命名法命名有机物A,名称为2,2,3三甲基戊烷
C.有机物A的分子式为C8H18
D.B的结构可能有3种,其中一种名称为3,4,4三甲基2戊烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用高分子吸附树脂提取卤水中的碘(主要以I-形式存在)的工艺流程如图,说法错误的是

A.流程②的反应说明Ⅰ的非金属性弱于Cl
B.经①和④所得溶液中,I-的浓度后者大于前者
C.氯元素的相对原子质量是35.5,则存在的35Cl、37Cl所占的百分比约为3:1
D.若在流程②和⑤中要得到等量的I2,则需消耗的n(Cl2):n(KClO3)=5:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某弱酸的酸式盐NaH2XO4和Na2HXO4,其中NaH2XO4溶液呈弱酸性,Na2HXO4呈弱碱性,在10℃时,浓度为0.1molL-1的NaH2XO4和Na2HXO4溶液中均存在的关系是( )
A.c(H+)c(OH-)>1×10-14
B.c(Na+)+c(H+)=c(H2XO4-)+c(OH-)+2c(HXO42-)+3c(XO43-)
C.c(H+)+2c(H3XO4)+c(H2XO4-)=c(XO43-)+c(OH-)
D.c(Na+)=c(H3XO4)+c(HXO42-)+c(XO43-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH3是一种重要的化工原料,其合成及应用一直备受广大化学工作者的关注。N2和H2生成NH3的反应为:N2(g)+3H2(g) ![]() 2NH3(g) △H=-92kJmol-1。
2NH3(g) △H=-92kJmol-1。
(1)已知:N2(g)![]() 2N(g) ; H2(g)
2N(g) ; H2(g)![]() 2H(g),则断开1 mol N-H键所需要的能量是_____________kJ。
2H(g),则断开1 mol N-H键所需要的能量是_____________kJ。
(2)有利于提高合成氨平衡产率的条件是_______________。
A.低温 B.高温 C.低压 D.高压 E.催化剂
(3)向一个恒温恒压容器充入1 mol N2和3mol H2模拟合成氨反应,下图为不同温度下平衡混合物中氨气的体积分数与总压强(p)的关系图。
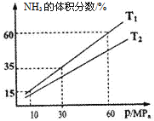
若体系在T1、60MPa下达到平衡。
①此时平衡常数Kp=___________ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数;列出计算式即可,无需化简)。
②T1_____________T2(填“>”、“<”或“=”)。
③达到平衡后,再向容器中充入适量氨气,达到新平衡时,c(H2)将______(填“增大”“减小”或“不变”)
(4)合成氨反应在催化剂作用下的反应历程为(*表示吸附态):
第一步 N2(g)→2N*;H2(g)→2H*(慢反应)
第二步 N*+H* ![]() NH*;NH*+H
NH*;NH*+H![]() NH2*;NH2* +H*
NH2*;NH2* +H*![]() NH3*;(快反应)
NH3*;(快反应)
第三步 NH3* ![]() NH3(g) (快反应)
NH3(g) (快反应)
比较第一步反应的活化能E1与第二步反应的活化能E2的大小:E1__________E2(填“>”、“<”或“=”),判断理由是________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.在NaClO和NaCl的混合溶液中:Ag+、K+、NO3-、I-
B.![]() =1×10-13mol·L-1的溶液中:NH4+、Ca2+、Cl-、NO3-
=1×10-13mol·L-1的溶液中:NH4+、Ca2+、Cl-、NO3-
C.K+、Na+、Br-、SiO32-在溶液中能大量共存通入过量CO2后仍能大量共存
D.由水电离的c(H+)=1×10-13mol·L-1的溶液中K+、Na+、AlO2-、CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某科研小组以难溶性钾长石(K2OAl2O36SiO2)为原料,提取Al2O3、K2CO3等物质,工艺流程如下:
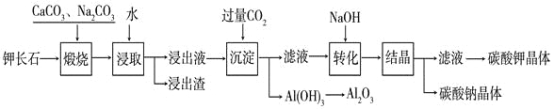
(1)煅烧过程中钾长石中的钾元素和铝元素在Na2CO3作用下转化为可溶性的NaAlO2和KAlO2,写出Al2O3转化为NaAlO2的化学方程式是:______________________________。
(2)已知NaAlO2和KAlO2易发生如下水解反应:AlO2—+ 2H2O![]() Al(OH)3 + OH— ,“浸取”时应保持溶液呈___________性(填“酸”或“碱”)。
Al(OH)3 + OH— ,“浸取”时应保持溶液呈___________性(填“酸”或“碱”)。
(3)“转化”时加入NaOH的主要作用是______________________________(用离子方程式表示)。
(4)上述工艺中可以循环利用的主要物质是_______________、_______________和水。
(5)以Al2O3为原料,以石墨为电极,通过电解法可制得金属铝。电解池中接电源负极的一极的电极反应式是___________________。长时间电解后,需要更换新的石墨电极的是________极(填“阴”或“阳”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用铝土矿(主要成分为Al2O3,还有少量的Fe2O3,SiO2等杂质)提取氧化铝作冶炼铝的原料,提取的操作过程如下:
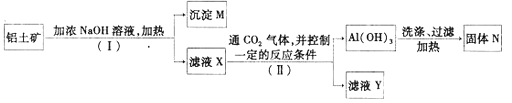
(1)Ⅰ和Ⅱ步骤中分离溶液和沉淀的操作是:_____________。
(2)沉淀M中除含有泥沙外,一定还含有_________(填化学式),生成固体N反应的化学方程式为_________。
(3)滤液X中,含铝元素的溶质的化学式为___________,它属于__________(填“酸”、“碱”或“盐”)类物质。
(4)实验室里常往AlCl3溶液中加入___________(填“氨水”或“NaOH溶液”)来制取Al(OH)3,该反应的离子方程式为__________________________。
(5)滤液Y中除了含有Na2CO3或NaHCO3外,一定还含有__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com