
【题目】某研究性学习小组设计了用氧化浓盐酸的方法制取氯气的实验,其实验装置如图:

(1)写出圆底烧瓶中发生反应的化学方程式:__。
(2)如果将过量的二氧化锰与20mL12mol·L-1的盐酸混合加热,充分反应后生成的氯气明显少于0.06mol。其主要的原因有①__;②__。
(3)L的作用是___;饱和食盐水的作用是__。
(4)为了提高浓盐酸的利用率,你对实验的建议是__。
【答案】MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O 加热使HCl大量挥发 盐酸变稀后不再发生反应 平衡压强作用,便于液体顺利流下 吸收氯气中的氯化氢 小火加热
MnCl2+Cl2↑+2H2O 加热使HCl大量挥发 盐酸变稀后不再发生反应 平衡压强作用,便于液体顺利流下 吸收氯气中的氯化氢 小火加热
【解析】
(1)二氧化锰与浓盐酸在加热条件下反应生成氯化锰、氯气和水;
(2)二氧化锰只能与浓盐酸发生反应,与稀盐酸不反应;
(3)L将分液漏斗与圆底烧瓶连接,起到平衡压强作用;浓盐酸易挥发,制备的氯气中含有氯化氢,氯化氢易溶于水;
(4)依据浓盐酸易挥发的性质解答。
(1)二氧化锰与浓盐酸在加热条件下反应生成氯化锰、氯气和水,化学方程式:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,故答案为:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O,故答案为:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O;
MnCl2+Cl2↑+2H2O;
(2))如果将过量的二氧化锰与20mL12mol·L-1的盐酸混合加热,充分反应后生成的氯气明显少于0.06mol的原因是浓盐酸具有挥发性,加热促进氯化氢的挥发,随着反应的进行,盐酸的浓度逐渐减小,二氧化锰只能与浓盐酸发生反应,与稀盐酸不反应,氯化氢不可能完全反应,故答案为:加热使HCl大量挥发;盐酸变稀后不再发生反应;
(3)L将分液漏斗与圆底烧瓶连接,起到平衡压强作用,便于液体顺利流下;浓盐酸易挥发,制备的氯气中含有氯化氢,氯化氢易溶于水,氯气在饱和食盐水中溶解度不大,所以可以用饱和食盐水吸收氯气中的氯化氢,故答案为:平衡压强作用,便于液体顺利流下;吸收氯气中的氯化氢;
(4)因为浓盐酸易挥发,为了提高浓盐酸的利用率,应小火加热,故答案为:小火加热。


科目:高中化学 来源: 题型:
【题目】下列有关实验操作、现象和结论都正确的是
选项 | 实验操作 | 现象 | 结论 |
A | 向BaCl2溶液中通入CO2 | 产生白色沉淀 | 白色沉淀为BaCO3 |
B | 向 NaHCO3溶液中先加入CaCl2溶液,再加入NaOH溶液 | 产生白色沉淀 | 白色沉淀为CaCO3 |
C | 向某溶液加入NaOH溶液,用湿润的红色石蕊试纸检验产生的气体 | 湿润的红色石蕊试纸未变蓝 | 该溶液中一定不含有 |
D | 向某溶液中先加入HNO3溶液,再加入BaCl2溶液 | 产生白色沉淀 | 该溶液中一定含有 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯乙腈主要用于有机合成及生产医药,农药的中间体,对环境有危害。常温常压下,苯乙腈水解一般需加入酸碱催化剂。但研究人员发现,在近临界水(指温度在523~623K之间的压缩液态水)中,不加任何催化剂的情况下,苯乙腈就能发生水解反应生成苯乙酞胺:
C6H5CH2CN(l)+H2O(l)![]() C6H5CH2CONH2(l) △H
C6H5CH2CONH2(l) △H
(苯乙腈) (苯乙酰胺)
请回答下列问题:
(1)己知近临界水中,水的离子积常数为10-10,则此条件下,pH=7的NaAc溶液中由水电离的c(H+)=________ mol·L-1。该反应不加任何催化剂就能发生的主要原因是___________。
(2)研究反应的平衡常数(记作lgK)与温度(T)的关系,得到如图1所示的关系,判断该反应的△H__________0(填“>”“<”或“=”)。
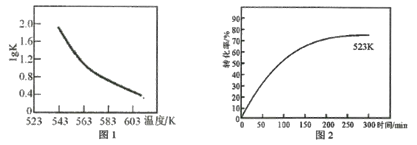
(3)图2表示其他条件不变时,温度和时间对苯乙腈转化率的影响曲线图(不完整)。若图中曲线对应的温度为523K,请你在原图中作出温度为583K的影响曲线。___________。
(4)下列哪种仪器可用于分析水解反应过程中苯乙腈浓度的变化_________(填编号)。
A.元素分析仪 B.核磁共振仪 C.原子吸收光谱仪 D.分光光度计
(5)科学家还在近临界水中分别添加CO2、NH3,研究后得到了如下的图示:
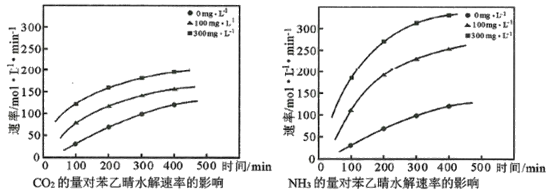
从中你可以得出什么结论(至少写出2点___________。
(6)水的用途很广,可利用太阳能光伏电池电解水制高纯氢,工作示意图如图。通过控制开关连接K1或K2,可交替得到H2和O2。
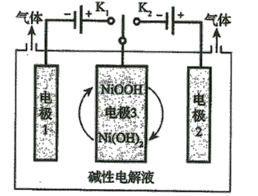
①制H2时,连接______________,可得H2。
②改变开关连接方式,产生O2的电极反应式__________________________。
③选用NiOOH、Ni(OH)2作为电极3材料的优点(请结合电极反应式进行阐述)___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验原理或实验操作正确的是
A. 实验室用装置A制取并收集二氧化硫
实验室用装置A制取并收集二氧化硫
B.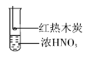 装置B的气体产物中检测出CO2,由此不能说明木炭一定与浓硝酸发生了反应
装置B的气体产物中检测出CO2,由此不能说明木炭一定与浓硝酸发生了反应
C.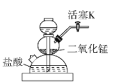 装置C可用于二氧化锰与浓盐酸反应制备氯气
装置C可用于二氧化锰与浓盐酸反应制备氯气
D.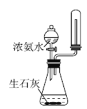 实验室用装置D制取少量氨气
实验室用装置D制取少量氨气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1 mol浓硫酸溶于水时包含两个过程:一是部分硫酸分子分散在水里吸收热量,热效应为Δ![]() ;二是部分硫酸分子与水作用形成硫酸水化物释放热量,热效应为Δ
;二是部分硫酸分子与水作用形成硫酸水化物释放热量,热效应为Δ![]() ,其中具体包含以下三个变化:①
,其中具体包含以下三个变化:①![]()
![]() ·
·![]() Δ
Δ![]() =Δ
=Δ![]()
②![]() ·
·![]()
![]() Δ
Δ![]() =Δ
=Δ![]()
③![]()
![]() Δ
Δ![]() =Δ
=Δ![]()
下列说法正确的是
A.浓硫酸溶于水只有化学变化
B.Δ![]() Δ
Δ![]() <0
<0
C.Δ![]() <0
<0
D.Δ![]() =Δ
=Δ![]() +Δ
+Δ![]() +Δ
+Δ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向100 mL NaOH溶液中通入一定量的CO2气体,充分反应后,再向所得溶液中逐滴加入0.2 mol·L-1的盐酸,产生CO2的体积与所加盐酸体积之间关系如图所示。
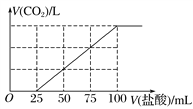
下列判断正确的是( )
A. 通入CO2在标准状况下的体积为448 mL
B. 原NaOH溶液的浓度为0.2 mol·L-1
C. 所得溶液的溶质成分的物质的量之比为n(NaOH)∶n(Na2CO3)=1∶3
D. 所得溶液的溶质成分的物质的量之比为n(NaHCO3)∶n(Na2CO3)=1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学反应的离子方程式正确的是( )
A. 氯化铝溶液与过量的氨水反应:Al3++4NH3·H2O===AlO![]() +4NH
+4NH![]() +2H2O
+2H2O
B. 小苏打溶液中加入过量的澄清石灰水:Ca2++2OH-+2HCO![]() ===CaCO3↓+ CO
===CaCO3↓+ CO![]() +2H2O
+2H2O
C. 纯碱溶液中滴加少量盐酸:CO32-+H+===HCO![]()
D. 用FeCl3溶液腐蚀铜电路板:Fe3++ Cu === Fe2++ Cu2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列物质:①氢氧化钡固体 ②KHSO4 ③HNO3 ④稀硫酸 ⑤二氧化碳气体 ⑥铁 ⑦碳酸钠粉末 ⑧蔗糖晶体 ⑨熔融氯化钠 ⑩CuSO4·5H2O晶体。请用序号填空:
(1)上述状态下可导电的是___。
(2)属于电解质的是___。
(3)属于非电解质的是____。
(4)⑥和水蒸气反应的化学方程式为___,①与②在溶液中反应使溶液呈中性的离子方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某容器中发生一个化学反应,反应过程中存在H2O、ClO-、CN-、HCO3-、N2、Cl-六种离子。在反应过程中测得ClO-和N2的物质的量随时间变化的曲线如图所示。下列有关判断中不正确的是( )
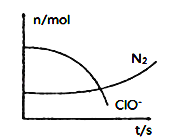
A.标准状况下若生成2.24LN2,则转移电子1mol
B.还原性:Cl-<CN-
C.参与反应的氧化剂与还原剂的物质的量之比为5:2
D.氧化剂是含ClO-的物质,氧化产物只有N2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com