
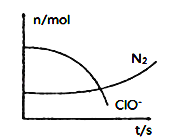
【题目】某容器中发生一个化学反应,反应过程中存在H2O、ClO-、CN-、HCO3-、N2、Cl-六种离子。在反应过程中测得ClO-和N2的物质的量随时间变化的曲线如图所示。下列有关判断中不正确的是( )
A.标准状况下若生成2.24LN2,则转移电子1mol
B.还原性:Cl-<CN-
C.参与反应的氧化剂与还原剂的物质的量之比为5:2
D.氧化剂是含ClO-的物质,氧化产物只有N2
【答案】D
【解析】
由曲线变化图可知,随反应进行ClO-的物质的量降低,N2的物质的量增大,故ClO-为反应物,N2是生成物,根据电子转移相等可知,CN-是反应物,由氯元素守恒可知Cl-是生成物,由碳元素守恒可知HCO3-是生成物,由氢元素守恒可知H2O是反应物.反应中Cl元素化合价由+1价降低为-1价,化合价总共降低2价,C元素化合价由+2价升高为+4价,N元素化合价由-3价升高为0价,化合价升降最小公倍数为2[(4-2)+(3-0)]=10价,故CN-系数为2,ClO-系数为5,由元素守恒可知HCO3-系数为2,N2系数为1,Cl-系数为5,H2O系数为1,反应方程式为2CN-+5ClO-+H2O=2HCO3-+N2↑+5Cl-,据此分析作答。
A. 2.24L N2(标准状况)的物质的量为0.1mol,所以参加反应的ClO的物质的量为0.5mol,反应中只有氯元素化合价降低,由ClO中+1价降低为Cl中1价,所以转移电子为0.5mol×2mol=1mol,A项正确;
B. 反应方程式为2CN-+5ClO-+H2O=2HCO3-+N2↑+5Cl-,还原剂为CN,还原产物为Cl-,还原剂的还原性大于还原产物的还原性,因此还原性比较:Cl-<CN-,B项正确;
C. 由上述分析可知,反应为2CN-+5ClO-+H2O=2HCO3-+N2↑+5Cl-,反应中是CN是还原剂,ClO是氧化剂,氧化剂与还原剂的化学计量数之比为5:2,C项正确;
D. 反应中,C元素化合价由CN中+2价升高为HCO3中+4价,N元素化合价由CN中3价升高为N2中0价,可知氧化产物有HCO3、N2,D项错误;
答案选D。


科目:高中化学 来源: 题型:
【题目】某研究性学习小组设计了用氧化浓盐酸的方法制取氯气的实验,其实验装置如图:

(1)写出圆底烧瓶中发生反应的化学方程式:__。
(2)如果将过量的二氧化锰与20mL12mol·L-1的盐酸混合加热,充分反应后生成的氯气明显少于0.06mol。其主要的原因有①__;②__。
(3)L的作用是___;饱和食盐水的作用是__。
(4)为了提高浓盐酸的利用率,你对实验的建议是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向1L恒容密闭容器中充入2mol SiHCl3,采用大孔弱碱性阴离子交换树脂催化剂,在323 K和343 K时发生反应2SiHCl3(g)=SiH2Cl2(g)+SiCl4(g) ΔH,SiHCl3的转化率随时间变化的结果如图所示。
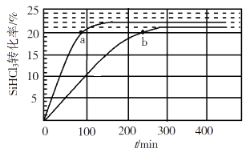
(1)上述反应每生成1g SiH2Cl2(g)吸收1.1kJ热量,则ΔH=______________。
(2)323K时,反应的平衡转化率α=______________。
(3)343K时,前200min内,SiCl4(g)的平均反应速率为______________。
(4)比较a、b两处反应速率大小![]() _______(填“>”“<”或“=”)
_______(填“>”“<”或“=”)![]() 。
。
(5)在343K条件下,要缩短反应达到平衡的时间,并且要增大平衡时SiH2Cl2(g)的浓度,可采取的措施是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A~M有如图转化关系,A与F分子中含碳原子数相同,均能与NaHCO3溶液反应,且A中含一个卤素原子,F的分子式为C9H10O2;D能发生银镜反应;M与NaOH溶液反应后的产物,其苯环上一氯代物只有一种。
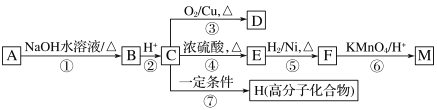
已知:![]() (R1、R2代表烃基或氢原子)
(R1、R2代表烃基或氢原子)
请回答:
(1)B、F的结构简式分别为__________、_________
(2)反应①~⑦中,属于消去反应的是_____________(填反应序号)。
(3)D发生银镜反应的化学方程式为______________;反应⑦的化学方程式为__________
(4)A的相对分子质量在180~260之间,从以上转化中不能确认A中含有哪种卤素原子,确定该官能团的实验步骤和现象为_____________
(5)符合下列条件F的同分异构体共有________种。
a.能发生银镜反应
b.能与FeCl3溶液发生显色反应
c.核磁共振氢谱上有四个峰,其峰面积之比为1∶1∶2∶6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,表中列出11种元素在周期表中的位置,按要求回答下列各题:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ⑥ | ⑧ | ||||||
3 | ① | ③ | ⑤ | ⑦ | ⑨ | |||
4 | ② | ④ | ⑩ |
(1)这11种元素中,化学性质最不活泼的元素是______(填元素符号,下同),得电子能力最强的原子是______,失电子能力最强的单质与水反应的化学方程式__。
(2)元素④的离子结构示意图为___________。
(4)写出③的单质置换出⑥的单质的化学方程式:_____。
①和⑤两种元素最高价氧化物对应的水化物相互反应的离子方程式为________。
②的最高价氧化物对应水化物与⑤的最高价氧化物反应的化学方程式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有50mL NaOH溶液,向其中逐渐通入一定量的CO2,随后取此溶液10mL将其稀释到100mL,并向此稀释后的溶液中逐滴加入0.1mol/L的HCl溶液,产生的CO2气体体积(标准状况下)与所加入的HCl的体积之间的关系如图所示:
甲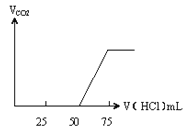 乙
乙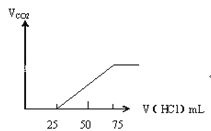
试
(1)NaOH在吸收CO2气体后,在甲、乙两种情况下,所得溶液中存在的溶质是甲:_____。
(2)乙情况下产生的CO2气体(标准状况)乙:______mL。
(3)原NaOH溶液的物质的量浓度是_____;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~H为中学化学中常见的物质,转化关系如下所示,其中“O”代表化合物,“□”代表单质,A为医疗上治疗胃酸过多的一种药剂,G为淡黄色固体,C在通常状况下为无色液体.
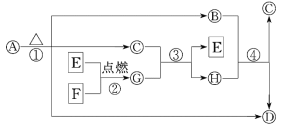
请回答下列问题:
(1)G的化学式为________,每生成1 mol G转移电子________mol.
(2)反应①②③④中________(填序号)属于氧化还原反应.
(3)写出下列反应的化学方程式:A→B+C+D:_______________________________,F+C:________________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学教师为 “氯气与金属钠反应”设计了如图装置的实验。实验操作:先给钠预热,到钠熔融成圆球时,撤火,通入氯气,即可见钠着火燃烧,生成大量白烟。以下叙述中错误的是( )

A. 反应生成的大量白烟是氯化钠晶体
B. 玻璃管尾部塞一团浸有NaOH溶液的棉球是用于吸收过量的氯气,以免其污染空气
C. 钠着火燃烧产生苍白色火焰
D. 发生的反应为2Na+Cl2![]() 2NaCl
2NaCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知2A2(g)+B2(g)![]() 2C3(g) △H=-Q1 kJ/mol(Q1>0), 在一个有催化剂的容积不变的密闭容器中加入2 molA2和1 molB2,在500℃时充分反应,达平衡后C3的浓度为w mol·L-1,放出热量为Q2 kJ。
2C3(g) △H=-Q1 kJ/mol(Q1>0), 在一个有催化剂的容积不变的密闭容器中加入2 molA2和1 molB2,在500℃时充分反应,达平衡后C3的浓度为w mol·L-1,放出热量为Q2 kJ。
(1)达到平衡时, A2的转化率为____________。
(2)达到平衡后,若向原容器中通入少量的氩气,A2的转化率将______(填“增大“、“减小”或“不变”)
(3)恒压的密闭容器中发生可逆反应2A2(g)+B2(g)![]() 2C3(g) △H=-Q1 kJ/mol(Q1>0),在一定条件下达到化学平衡状态的标志是 (____)
2C3(g) △H=-Q1 kJ/mol(Q1>0),在一定条件下达到化学平衡状态的标志是 (____)
A. v(A2):v(C3)=3:2
B.反应混合气体的密度不再变化
C.反应混合气体的平均摩尔质量不再变化
D.A2、B2两种反应物的转化率不再变化
E. A2、B2、C3三种物质的浓度相等
F.密闭容器内的压强不再变化
(4)改变某一条件,得到如上图的变化规律(图中T表示温度,n表示物质的量),可得出的结论正确的是____;
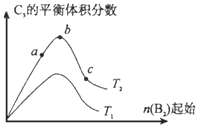
a.反应速率c>b>a
b.达到平衡时A2的转化率大小为:b>a>c
c.T2>T1
d.b点A2和B2的物质的量之比为2:1
(5)若将上述容器改为恒压容器,起始时加入2 molA2和1 molB2,500℃时充分反应达平衡后,放出热量Q4 kJ,则Q2_______Q4(填“>”、“<”或“=”)。
(6)下列措施可以同时提高反应速率和B2的转化率是_______(填选项序号)。
a.选择适当的催化剂 b.增大压强
c.及时分离生成的C3 d.升高温度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com