
【题目】下表为元素周期表的一部分,表中列出11种元素在周期表中的位置,按要求回答下列各题:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ⑥ | ⑧ | ||||||
3 | ① | ③ | ⑤ | ⑦ | ⑨ | |||
4 | ② | ④ | ⑩ |
(1)这11种元素中,化学性质最不活泼的元素是______(填元素符号,下同),得电子能力最强的原子是______,失电子能力最强的单质与水反应的化学方程式__。
(2)元素④的离子结构示意图为___________。
(4)写出③的单质置换出⑥的单质的化学方程式:_____。
①和⑤两种元素最高价氧化物对应的水化物相互反应的离子方程式为________。
②的最高价氧化物对应水化物与⑤的最高价氧化物反应的化学方程式为________。
【答案】Ne F 2K+2H2O═2KOH+H2↑ 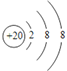 PH3 HClO4 2Mg+CO2
PH3 HClO4 2Mg+CO2![]() 2MgO+C OH-+Al(OH)3═AlO2-+2H2O Al2O3+2KOH═2KAlO2+H2O
2MgO+C OH-+Al(OH)3═AlO2-+2H2O Al2O3+2KOH═2KAlO2+H2O
【解析】
(1)根据11种元素所在元素周期表的位置,化学性质最不活泼的元素是,即为Ne;得电子能力最强的原子为氟元素;失电子能力最强的元素是②,即K,K与H2O反应的方程式为2K+2H2O=2KOH+H2↑;
(2)元素④为Ca,其离子为Ca2+,结构示意图为 ;
;
(3)⑦为P,其气态氢化物的化学式为PH3;⑨为Cl,最高价氧化物对应水化物的化学式为HClO4;
(4)③为Mg,⑥为C,Mg在CO2中燃烧发生置换反应,反应的方程式为2Mg+CO2![]() 2MgO+C;①⑤两者最高价氧化物对应水化物分别是NaOH、Al(OH)3,氢氧化铝属于两性氢氧化物,两者反应的离子方程式为OH-+Al(OH)3=AlO2-+2H2O;②的最高价氧化物对应水化物是KOH,⑤的最高价氧化物是Al2O3,Al2O3为两性氧化物,两者反应的化学方程式为Al2O3+2KOH=2KAlO2+H2O。
2MgO+C;①⑤两者最高价氧化物对应水化物分别是NaOH、Al(OH)3,氢氧化铝属于两性氢氧化物,两者反应的离子方程式为OH-+Al(OH)3=AlO2-+2H2O;②的最高价氧化物对应水化物是KOH,⑤的最高价氧化物是Al2O3,Al2O3为两性氧化物,两者反应的化学方程式为Al2O3+2KOH=2KAlO2+H2O。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】1 mol浓硫酸溶于水时包含两个过程:一是部分硫酸分子分散在水里吸收热量,热效应为Δ![]() ;二是部分硫酸分子与水作用形成硫酸水化物释放热量,热效应为Δ
;二是部分硫酸分子与水作用形成硫酸水化物释放热量,热效应为Δ![]() ,其中具体包含以下三个变化:①
,其中具体包含以下三个变化:①![]()
![]() ·
·![]() Δ
Δ![]() =Δ
=Δ![]()
②![]() ·
·![]()
![]() Δ
Δ![]() =Δ
=Δ![]()
③![]()
![]() Δ
Δ![]() =Δ
=Δ![]()
下列说法正确的是
A.浓硫酸溶于水只有化学变化
B.Δ![]() Δ
Δ![]() <0
<0
C.Δ![]() <0
<0
D.Δ![]() =Δ
=Δ![]() +Δ
+Δ![]() +Δ
+Δ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备1,2-二溴乙烷的反应原理如下:![]()
可能存在的主要副反应有:乙醇在浓硫酸的存在下在140℃脱水生成乙醚.用少量溴和足量的乙醇制备1,2-二溴乙烷的装置如图所示:有关数据列表如下:
回答下列问题:
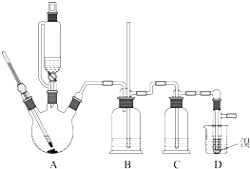
乙醇 | 1,2—二溴乙烷 | 乙醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/g.cm-3- | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | -130 | 9 | -116 |
【1】在此制备实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是______;(填正确选项前的字母)
a 引发反应 b 加快反应速度 c 防止乙醇挥发 d 减少副产物乙醚生成
【2】装置B的作用_____________。
【3】在装置C中应加入______,其目的是吸收反应中可能生成的酸性气体;(填正确选项前的字母)
a 水 b 浓硫酸 c 氢氧化钾溶液 d 饱和碳酸氢钠溶液
【4】判断该制备反应已经结束的最简单方法是___________;将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在______层(填“上”、“下”);
【5】若产物中有少量未反应的Br2,最好用________洗涤除去;若产物中有少量副产物乙醚,可用____的方法除去;
【6】反应过程中应用冷水冷却装置D,其主要目的是_______;
【7】但又不能过度冷却(如用冰水),其原因是_______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用海水可以提取溴和镁,提取过程如下:

(1)提取溴的过程中,经过2次Br-→Br2转化的目的是_______,吸收塔中发生反应的离子方程式是SO2+Br2+2H2O=4H++2Br-+SO42-,蒸馏塔中发生反应的离子方程式是_____。
(2)从MgCl2溶液中得到MgCl26H2O晶体的主要操作是_________、冷却结晶、过滤、洗涤、干燥。由无水氯化镁得到镁的化学方程式是___。
(3)海水提取镁要用到海滩上的贝壳,贝壳的作用是:_______,贝壳经历变化的化学方程式为:____,CaO+H2O = Ca(OH)2
(4)六水合氯化镁脱水变成无水氯化镁的工艺条件是:____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验室需要 1.0 mol/L 的碳酸钠溶液 450 mL,利用碳酸钠晶体(Na2CO3·10H2O)来配制。下列说法正确的是
A. 应称取该碳酸钠晶体128.7 g
B. 取 100 mL 该溶液,向其中加入100 mL 水,所得溶液浓度为0.5 mol/L
C. 定容时俯视刻度线会引起配制溶液的浓度偏高
D. 定容、摇匀、静置后发现液面低于刻度线,应再补加少量水至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某容器中发生一个化学反应,反应过程中存在H2O、ClO-、CN-、HCO3-、N2、Cl-六种离子。在反应过程中测得ClO-和N2的物质的量随时间变化的曲线如图所示。下列有关判断中不正确的是( )
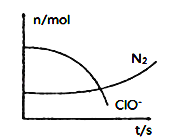
A.标准状况下若生成2.24LN2,则转移电子1mol
B.还原性:Cl-<CN-
C.参与反应的氧化剂与还原剂的物质的量之比为5:2
D.氧化剂是含ClO-的物质,氧化产物只有N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把3.06 g铝和镁的混合物粉末放入100 mL盐酸中,恰好完全反应,并得到标准状况下3.36 LH2 计算:(要有过程)
(1)该合金中铝的物质的量_____。
(2)反应后溶液中Cl﹣的物质的量浓度(假定反应体积仍为100 mL)____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学向两个容积相同的烧瓶内分别充入一定量的HCl与NH3(假设烧瓶内其它气体难溶于水)。利用如图所示的装置进行实验,实验开始前各活塞均关闭。
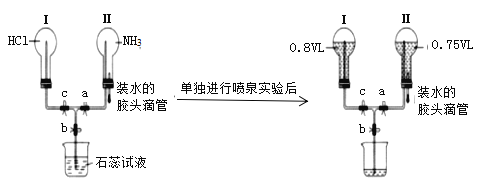
(1)同温同压下,两个烧瓶内充入的HCl与NH3分子数目之比为___,烧瓶Ⅱ中喷泉的颜色是___。
(2)单独进行喷泉实验后,烧瓶I中c(Cl-)=___molL-1(实验条件下气体摩尔体积为Vm)
(3)实验表明,若只是关闭b、打开a、c,则易在烧瓶I中观察到白烟,这表明气体分子扩散速率随着气体相对分子质量的增大而____(填“增大”或“减小”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关下列四个常用电化学装置的叙述中,正确的是 ( )
|
|
|
|
图Ⅰ 碱性锌锰电池 | 图Ⅱ 铅硫酸蓄电池 | 图Ⅲ 电解精炼铜 | 图Ⅳ 银锌纽扣电池 |
A.图Ⅰ所示电池中,MnO2的作用是催化剂
B.图Ⅱ所示电池放电过程中,硫酸浓度不断减小
C.图Ⅲ所示装置工作过程中,电解质溶液中Cu2+浓度始终不变
D.图Ⅳ所示电池中,Ag2O是还原剂,电池工作过程中生成Ag
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com