
【题目】有关下列四个常用电化学装置的叙述中,正确的是 ( )
|
|
|
|
图Ⅰ 碱性锌锰电池 | 图Ⅱ 铅硫酸蓄电池 | 图Ⅲ 电解精炼铜 | 图Ⅳ 银锌纽扣电池 |
A.图Ⅰ所示电池中,MnO2的作用是催化剂
B.图Ⅱ所示电池放电过程中,硫酸浓度不断减小
C.图Ⅲ所示装置工作过程中,电解质溶液中Cu2+浓度始终不变
D.图Ⅳ所示电池中,Ag2O是还原剂,电池工作过程中生成Ag
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,表中列出11种元素在周期表中的位置,按要求回答下列各题:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ⑥ | ⑧ | ||||||
3 | ① | ③ | ⑤ | ⑦ | ⑨ | |||
4 | ② | ④ | ⑩ |
(1)这11种元素中,化学性质最不活泼的元素是______(填元素符号,下同),得电子能力最强的原子是______,失电子能力最强的单质与水反应的化学方程式__。
(2)元素④的离子结构示意图为___________。
(4)写出③的单质置换出⑥的单质的化学方程式:_____。
①和⑤两种元素最高价氧化物对应的水化物相互反应的离子方程式为________。
②的最高价氧化物对应水化物与⑤的最高价氧化物反应的化学方程式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究SO2的性质,按下图所示装置进行实验。
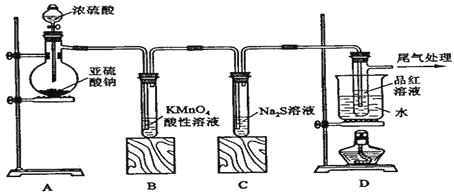
请到答F列问题:
(1)装置A中盛放亚硫酸钠的仪器名称是 ,其中发生反应的化学方程式为 ;
(2)实验过程中,装置B、C中发生的现象分别是 、 ,这些现象分别说明SO2具有的性质是 和 ;装置B中发生反应的离子方程式为 ;
(3)装置D的目的是探究SO2与品红作用的可逆性,请写出实验操作及现象 ;
(4)尾气可采用 溶液吸收。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
①标准状况下,6. 02×1023个分子所占的体积约是22. 4 L
②0. 5 mol H2所占体积为11. 2 L
③标准状况下,1 mol H2 O的体积为22.4 L
④标准状况下,28 g CO与N2的混 合气体的体积约为22. 4 L
⑤各种气体的气体摩尔体积都 约为22. 4 L/mol
⑥标准状况下,体积相同的气体的分子数相同
A.①③⑤B.④⑥C.③④⑥D.①④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是温度和压强对反应X+Y![]() 2Z影响的示意图。图中横坐标表示温度,纵坐标表示平衡混合气体中Z的体积分数。下列叙述正确的是( )
2Z影响的示意图。图中横坐标表示温度,纵坐标表示平衡混合气体中Z的体积分数。下列叙述正确的是( )
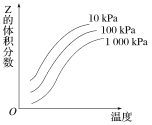
A.上述可逆反应的正反应为放热反应B.X、Y、Z均为气态
C.X和Y中最多只有一种为气态,Z为气态D.上述反应的逆反应的ΔH>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知2A2(g)+B2(g)![]() 2C3(g) △H=-Q1 kJ/mol(Q1>0), 在一个有催化剂的容积不变的密闭容器中加入2 molA2和1 molB2,在500℃时充分反应,达平衡后C3的浓度为w mol·L-1,放出热量为Q2 kJ。
2C3(g) △H=-Q1 kJ/mol(Q1>0), 在一个有催化剂的容积不变的密闭容器中加入2 molA2和1 molB2,在500℃时充分反应,达平衡后C3的浓度为w mol·L-1,放出热量为Q2 kJ。
(1)达到平衡时, A2的转化率为____________。
(2)达到平衡后,若向原容器中通入少量的氩气,A2的转化率将______(填“增大“、“减小”或“不变”)
(3)恒压的密闭容器中发生可逆反应2A2(g)+B2(g)![]() 2C3(g) △H=-Q1 kJ/mol(Q1>0),在一定条件下达到化学平衡状态的标志是 (____)
2C3(g) △H=-Q1 kJ/mol(Q1>0),在一定条件下达到化学平衡状态的标志是 (____)
A. v(A2):v(C3)=3:2
B.反应混合气体的密度不再变化
C.反应混合气体的平均摩尔质量不再变化
D.A2、B2两种反应物的转化率不再变化
E. A2、B2、C3三种物质的浓度相等
F.密闭容器内的压强不再变化
(4)改变某一条件,得到如上图的变化规律(图中T表示温度,n表示物质的量),可得出的结论正确的是____;
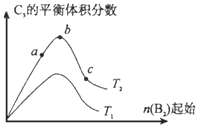
a.反应速率c>b>a
b.达到平衡时A2的转化率大小为:b>a>c
c.T2>T1
d.b点A2和B2的物质的量之比为2:1
(5)若将上述容器改为恒压容器,起始时加入2 molA2和1 molB2,500℃时充分反应达平衡后,放出热量Q4 kJ,则Q2_______Q4(填“>”、“<”或“=”)。
(6)下列措施可以同时提高反应速率和B2的转化率是_______(填选项序号)。
a.选择适当的催化剂 b.增大压强
c.及时分离生成的C3 d.升高温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值,下列说法正确的是( )
A. 标准状况下,22.4 L水含有的水分子数为NA
B. 常温常压下,22 g CO2含有的CO2分子数为0.5NA
C. 标准状况下,32 g O2和CO2的混合气体含有的氧原子数为2NA
D. 40 g NaOH溶解在1 L水中,得到溶液的物质的量浓度为1 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氯化二硫(S2C12)是工业上常用的硫化剂。常温下是一种液体,沸点137℃,易与水反应。实验室可通过硫与少量氯气在110140℃反应制得S2Cl2粗品,氯气过量则会生成SCl2。
(1)选取以下装置制取少量S2Cl2:

①仪器m的名称为_____________。
②装置连接顺序:A→________________________________→E→D。
③A中发生反应的离子方程式为 _________________________。
④装置F的作用是____________________。
⑤D中的最佳试剂是__________(填标号)。
a.碱石灰 b.浓硫酸 c.无水氯化钙
⑥为了提高S2Cl2的纯度,关键的是控制好温度和_______________________。
(2)S2Cl2遇水会生成SO2、HCl两种气体,某同学设计了如下实验方案来测定该混合物的SO2的体积分数。

①W溶液可以是下列溶液中的__________(填标号);
a.H2O2溶液 b.KMnO4溶液(硫酸酸化) c.氯水
②该混合气体中二氧化硫的体积分数为__________(含V、m的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用化学用语表示Na2CO3+2Cl2===2NaCl+Cl2O+CO2中的相关微粒,其中正确的是( )
A. Na+的结构示意图:![]()
B. Cl2O的结构式:Cl—O—Cl
C. 中子数比质子数多3的氯原子:3517Cl
D. CO2的电子式:![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com