
【题目】如图是温度和压强对反应X+Y![]() 2Z影响的示意图。图中横坐标表示温度,纵坐标表示平衡混合气体中Z的体积分数。下列叙述正确的是( )
2Z影响的示意图。图中横坐标表示温度,纵坐标表示平衡混合气体中Z的体积分数。下列叙述正确的是( )
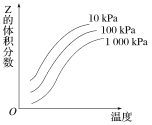
A.上述可逆反应的正反应为放热反应B.X、Y、Z均为气态
C.X和Y中最多只有一种为气态,Z为气态D.上述反应的逆反应的ΔH>0
【答案】C
【解析】
由图可知,随着温度的升高,Z的体积分数增加,故正反应为吸热反应,逆反应为放热反应,且在相同温度下,压强越大,Z的体积分数越小,则若Z为气态,X、Y中只有一个气态物质。根据此分析进行解答。
A.由图像可知,随温度升高Z的体积分数增大,该反应为吸热反应,故A选项错误;
B.相同温度下,压强越大,Z的体积分数越小,说明增加压强平衡左移,X、Y中至少有一种不是气体,故B选项错误;
C.相同温度下,压强越大,Z的体积分数越小,说明增加压强平衡左移,则若Z为气态,X、Y中最多只有一种气态物质,故选C选项正确;
D.由图像可知,随温度升高Z的体积分数增大,正反应为吸热反应,逆反应为放热反应,逆反应的ΔH小于0,故D选项错误。
故答案选C。


 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:
【题目】某实验室需要 1.0 mol/L 的碳酸钠溶液 450 mL,利用碳酸钠晶体(Na2CO3·10H2O)来配制。下列说法正确的是
A. 应称取该碳酸钠晶体128.7 g
B. 取 100 mL 该溶液,向其中加入100 mL 水,所得溶液浓度为0.5 mol/L
C. 定容时俯视刻度线会引起配制溶液的浓度偏高
D. 定容、摇匀、静置后发现液面低于刻度线,应再补加少量水至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是一种实验某气体化学性质的实验装置,图中B为开关。如先打开B,在A处通入干燥的氯气,C中红色布条颜色无变化;当关闭B时,C处红色布条褪色。则D瓶中盛有的溶液是( )

A. 浓硫酸B. 饱和氯化钠溶液C. 浓氢氧化钠溶液D. 氢氧化钙悬浊液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组在实验室研究SO2与Ba(NO3)2溶液的反应:
实验:向盛有2mL0.1mol/LBa(NO3)2溶液的试管中,缓慢通入SO2气体,试管内有白色沉淀产生,液面上方略显浅棕色。
探究1:白色沉淀产生的原因。
(1)白色沉淀是___。
(2)分析白色沉淀产生的原因,甲同学认为是NO3-氧化了SO2,乙同学认为是溶液中溶解的O2氧化了SO2。
①支持甲同学观点的实验证据是_____________________________________。
②依据甲的推断,请写出Ba(NO3)2溶液与SO2反应的离子方程式___________________________________。
③乙同学通过下列实验证明了自己的推测正确,请完成实验方案:
实验操作 | 实验现象 |
向2mL____mol/L____溶液(填化学式)中通入SO2 | ____________ |
探究2:在氧化SO2的过程中,NO3-和O2哪种微粒起了主要作用。
实验操作 | 实验数据 |
向烧杯中加入煮沸了的0.1mol/L的BaCl2溶液25mL,再加入25mL植物油,冷却至室温,通入SO2,用pH传感器测定溶液pH随时间(t)的变化曲线 |
图1:向BaCl2(无氧)溶液中通入SO2 |
向烧杯中分别加入25mL0.1mol/L的BaCl2溶液、Ba(NO3)2溶液,通入SO2,用pH传感器分别测定溶液pH随时间(t)变化的曲线。 |
图2:分别向BaCl2、Ba(NO3)2溶液中通入SO2 |
(3)图1,在无氧条件下,BaCl2溶液pH下降的原因是______________________________。
(4)图2,BaCl2溶液中发生反应的离子方程式为_________。
(5)依据上述图像你得出的结论是________,说明理由_________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z、W是中学常见的四种元素,原子序数依次增大。X的原子最外层电子数是次外层的2倍,Y 的氧化物属于两性氧化物,Y、Z 位于同周期,X、Y、Z的原子最外层电子数之和为14,W是人体必需的微量元素,缺乏W会导致贫血症状。
(1)X在元素周期表中的位置是_________________。
(2)下列事实能用元素周期律解释的是_____________________________________(填字母序号)。
A.Y 的最高价氧化物对应水化物的碱性弱于Mg(OH)2
B.Z的气态氢化物的稳定性小于HF
C.WZ3的溶液可用于刻蚀铜制的印刷电路板
(3)Z的单质可以从NaBr溶液中置换出Br2单质,从原子结构的角度解释其原因是______________________。
(4)工业上用电解法制备Y单质,化学方程式为___________________________。
(5)家用“管道通”的有效成分是烧碱和Y 的单质,使用时需加入一定量的水,此时发生反应的化学方程式为______________________________。
(6)W的单质可用于处理酸性废水中的NO3-,使其转化成为铵根离子,同时生成磁性的W的氧化物H,再进行后续处理。相应离子方程式为____________。Y 的单质与H在高温下反应的化学方程式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关下列四个常用电化学装置的叙述中,正确的是 ( )
|
|
|
|
图Ⅰ 碱性锌锰电池 | 图Ⅱ 铅硫酸蓄电池 | 图Ⅲ 电解精炼铜 | 图Ⅳ 银锌纽扣电池 |
A.图Ⅰ所示电池中,MnO2的作用是催化剂
B.图Ⅱ所示电池放电过程中,硫酸浓度不断减小
C.图Ⅲ所示装置工作过程中,电解质溶液中Cu2+浓度始终不变
D.图Ⅳ所示电池中,Ag2O是还原剂,电池工作过程中生成Ag
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知:① CH3OH(g)+H2O(g)===CO2(g)+3H2(g) ΔH=+49.0 kJ/mol
② CH3OH(g)+3/2O2(g)===CO2(g)+2H2O(g) ΔH=-192.9 kJ/mol
由上述方程式可知:CH3OH的燃烧热________(填“大于”“等于”或“小于”)192.9 kJ/mol。
已知水的气化热为44 kJ/mol。则表示氢气燃烧热的热化学方程式为__________。
(2)以CO2与NH3为原料可合成化肥尿素[化学式为CO(NH2)2]。
已知:① 2NH3(g)+CO2(g)===NH2CO2NH4(s) ΔH=-159.5 kJ/mol
②NH2CO2NH4(s)===CO(NH2)2(s)+H2O(g) ΔH=+116.5 kJ/mol
③H2O(l)===H2O(g) ΔH=+44.0 kJ/mol
写出CO2与NH3合成尿素和液态水的热化学方程式是______。
(3)已知:① Fe(s)+1/2O2(g)===FeO(s) ΔH1=-272.0 kJ/mol
② 2Al(s)+3/2O2(g)===Al2O3(s) ΔH2=-1675.7 kJ/mol
Al和FeO发生铝热反应的热化学方程式是______。某同学认为,铝热反应可用于工业炼铁,你的判断是______(填“能”或“不能”),你的理由是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】离子交换法制取纯净水的过程如下图所示。
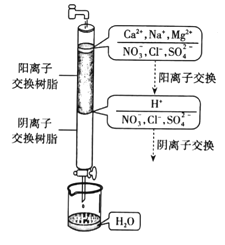
请根据图示回答下列问题:
(1)若水龙头中出来的是硬水,则其中含有较多的___离子。
(2)阳离子交换树脂中所含的大量阳离子是___,根据电荷守恒可知,通过阳离子交换树脂后,水中阳离子的数目___(填“增多”、“减少”或“不变”)。
(3)水中的NO3、Cl、SO42,通过阴离子交换树脂转化为___离子,进而与H+反应生成H2O,有关反应的离子方程式为___。
(4)通过净化处理后,水的导电能力___(填“增强”、“减弱”或“不变”),原因是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:CH4(g)+4NO3(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574kJ/mol
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160kJ/mol
若用标准状况下4.48 LCH4还原NO2至N2,整个过程中转移的电子总数________(阿伏伽德罗常数用NA表示),放出的热量为_________kJ。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com