
【题目】已知2A2(g)+B2(g)![]() 2C3(g) △H=-Q1 kJ/mol(Q1>0), 在一个有催化剂的容积不变的密闭容器中加入2 molA2和1 molB2,在500℃时充分反应,达平衡后C3的浓度为w mol·L-1,放出热量为Q2 kJ。
2C3(g) △H=-Q1 kJ/mol(Q1>0), 在一个有催化剂的容积不变的密闭容器中加入2 molA2和1 molB2,在500℃时充分反应,达平衡后C3的浓度为w mol·L-1,放出热量为Q2 kJ。
(1)达到平衡时, A2的转化率为____________。
(2)达到平衡后,若向原容器中通入少量的氩气,A2的转化率将______(填“增大“、“减小”或“不变”)
(3)恒压的密闭容器中发生可逆反应2A2(g)+B2(g)![]() 2C3(g) △H=-Q1 kJ/mol(Q1>0),在一定条件下达到化学平衡状态的标志是 (____)
2C3(g) △H=-Q1 kJ/mol(Q1>0),在一定条件下达到化学平衡状态的标志是 (____)
A. v(A2):v(C3)=3:2
B.反应混合气体的密度不再变化
C.反应混合气体的平均摩尔质量不再变化
D.A2、B2两种反应物的转化率不再变化
E. A2、B2、C3三种物质的浓度相等
F.密闭容器内的压强不再变化
(4)改变某一条件,得到如上图的变化规律(图中T表示温度,n表示物质的量),可得出的结论正确的是____;
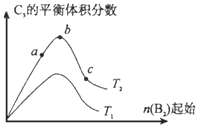
a.反应速率c>b>a
b.达到平衡时A2的转化率大小为:b>a>c
c.T2>T1
d.b点A2和B2的物质的量之比为2:1
(5)若将上述容器改为恒压容器,起始时加入2 molA2和1 molB2,500℃时充分反应达平衡后,放出热量Q4 kJ,则Q2_______Q4(填“>”、“<”或“=”)。
(6)下列措施可以同时提高反应速率和B2的转化率是_______(填选项序号)。
a.选择适当的催化剂 b.增大压强
c.及时分离生成的C3 d.升高温度
【答案】Q2/Q1 不变 BCD ad < b
【解析】
2A2(g)+B2(g)![]() 2C3(g) △H=-Q1 kJ/mol
2C3(g) △H=-Q1 kJ/mol
初始: 2 1
反应: x x/2 x xQ1/2
平衡: Q2
(1)根据分析可知,xQ1/2=Q2,则x=2Q2/Q1,A2的转化率=x/2=(2Q2/Q1)÷2=Q2/Q1;
(2)达到平衡后,若向原容器中通入少量的氩气,容器的容积不变,反应体系中各物质的浓度不变,则平衡不移动,A2的转化率不变;
(3)A. v(A2):v(C3)=3:2,无法判断同一物质的正逆反应速率的关系,不能判断是否达到平衡状态,A错误;
B.反应体系中各物质均为气态,则总质量不变,容器为恒压装置,容器的容积随反应的进行不断改变,则反应混合气体的密度不再变化说明达到平衡状态,B正确;
C.M=m/n,总气体的质量不变,若平衡时,总物质的量不再改变,反应混合气体的平均摩尔质量不再变化,可判断达到平衡状态,C正确;
D.A2、B2两种反应物的转化率不再变化,则物质的量不再改变,达到平衡状态,D正确;
E. A2、B2、C3三种物质的浓度相等,无法判断同一物质的正逆反应速率的关系,不能判断是否达到平衡状态,E错误;
F.容器为恒压装置,则密闭容器内的压强一直不变,压强不变不能作为判断平衡的依据,F错误;
答案为BCD;
(4)a.T2时,增大n(B2),平衡正向移动,则反应速率c>b>a,a正确;
b.增加n(B2)用量,A2的转化率增大,达到平衡时A2的转化率大小为:c>b>a,B错误;
c.该反应为放热反应,加入n(B2)相同时,升高温度,平衡逆向移动,C3百分含量降低,则T1>T2,c错误;
d.b点A2和B2的物质的量之比为2:1时转化率达到最大值,d正确;
答案为ad;
(5)恒压时与恒容时的温度、初始量相同,先使恒压装置保持容积不变,达到平衡时,与恒容相同,反应时物质的量减小,则减小体积增大压强,保持与初始压强相同,与恒容时相比,反应正向移动,释放的热量更多,则Q2<Q4;
(6)a.选择适当的催化剂对平衡无影响,转化率不变,a错误;
b.增大压强,体积减小,平衡正向移动,转化率增大,速率提高,b正确;
c.及时分离生成的C3,反应速率降低,转化率增大,c错误;
d.升高温度,反应速率升高,转化率降低,d错误;
答案为b。


 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】某容器中发生一个化学反应,反应过程中存在H2O、ClO-、CN-、HCO3-、N2、Cl-六种离子。在反应过程中测得ClO-和N2的物质的量随时间变化的曲线如图所示。下列有关判断中不正确的是( )
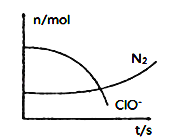
A.标准状况下若生成2.24LN2,则转移电子1mol
B.还原性:Cl-<CN-
C.参与反应的氧化剂与还原剂的物质的量之比为5:2
D.氧化剂是含ClO-的物质,氧化产物只有N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上利用铁的氧化物在高温条件下循环裂解水制氢气的流程如下图所示。

(1)反应I的化学方程式为:Fe3O4(s)+CO(g)![]() 3FeO(s)+CO2(g),反应Ⅱ的化学方程式为_________,对比反应I、Ⅱ,铁的氧化物在循环裂解水制氢气过程中的作用是_________。用化学方程式表示反应I、Ⅱ、Ⅲ的总结果:_________。
3FeO(s)+CO2(g),反应Ⅱ的化学方程式为_________,对比反应I、Ⅱ,铁的氧化物在循环裂解水制氢气过程中的作用是_________。用化学方程式表示反应I、Ⅱ、Ⅲ的总结果:_________。
(2)反应III为:CO2(g)+C(s)![]() 2CO(g)
2CO(g) ![]() H>0。为了提高达平衡后CO的产量,理论上可以采取的合理措施有_________(任写一条措施)。
H>0。为了提高达平衡后CO的产量,理论上可以采取的合理措施有_________(任写一条措施)。
(3)上述流程中铁的氧化物可用来制备含有Fe3+的刻蚀液,用刻蚀液刻蚀铜板时,可观察到溶液颜色逐渐变蓝,该反应的离子方程式为_________。刻蚀液使用一段时间后会失效,先加酸,再加入过氧化氢溶液,可实现刻蚀液中Fe3+的再生,该反应的离子方程式为_________。
(4)上述流程中碳的氧化物可用来制备碳酰肼[CO(NHNH2)2,其中碳元素为+4价]。加热条件下,碳酰肼能将锅炉内表面锈蚀后的氧化铁转化为结构紧密的四氧化三铁保护层,并生成氮气、水和二氧化碳。该反应的化学方程式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一个容积为V的密闭容器,中间有一可自由滑动的隔板(厚度不计)将容器分成两部分,当左边充入1molN2,右边充入一定量的CO时,隔板处于如图位置(保持温度不变),下列说法正确的是( )
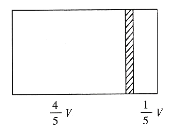
A.右边与左边分子数之比为4:1
B.右侧CO的质量为5.6g
C.右侧气体密度是相同条件下氢气密度的14倍
D.若改变右边CO的充入量而使隔板处于容器正中间,保持温度不变,则应充入0.2molCO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关下列四个常用电化学装置的叙述中,正确的是 ( )
|
|
|
|
图Ⅰ 碱性锌锰电池 | 图Ⅱ 铅硫酸蓄电池 | 图Ⅲ 电解精炼铜 | 图Ⅳ 银锌纽扣电池 |
A.图Ⅰ所示电池中,MnO2的作用是催化剂
B.图Ⅱ所示电池放电过程中,硫酸浓度不断减小
C.图Ⅲ所示装置工作过程中,电解质溶液中Cu2+浓度始终不变
D.图Ⅳ所示电池中,Ag2O是还原剂,电池工作过程中生成Ag
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中,对可逆反应A+3B![]() 2C(g),平衡时C的体积分数与温度和压强的关系如图所示,下列判断错误的是
2C(g),平衡时C的体积分数与温度和压强的关系如图所示,下列判断错误的是
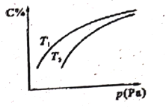
A.若正反应方向Q<0,则T1>T2
B.A可能为气体
C.压强增大时,混合气体的平均相对分子质量增大
D.B不一定为气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列说法正确的是()
A.2g氢气中的原子数为NA
B.1mol/LCaCl2溶液中Cl- 数为2NA
C.标准状况下22.4LCO2中原子数为3NA
D.2L2mol/LC2H5OH溶液中分子数为4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】制烧碱所用的盐水需进行两次的精制。
(1)第一次精制主要是用沉淀法除去粗盐水中Ca2+、Mg2+、SO42-等离子,过程如下:
I.向粗盐水中加入过量X,过滤。
II.向所得滤液中加入过量Y,过滤。
III.滤液用盐酸调节pH,获得一次精制盐水。
请回答下列问题:
①X是__________。
②Y是___________,加入Y的主要目的_______________。
③经检测,II中过滤所得的沉淀中还含有Mg2(OH)2CO3,生成该沉淀的离子方程式是________。
(2)第二次精制要除去一次精制盐水中微量的IO3-、NH4+、Ca2+、Mg2+,流程示意图如下:
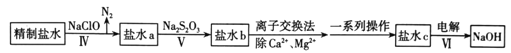
①IV中除去的离子是____________(填化学式),判断的理由是_______。
②V中得到的溶液颜色呈棕黄色,由此说明Na2S2O3将IO3-还原为______(填化学式),同时Na2S2O3被氧化为SO42-。此反应中体现了Na2S2O3的_________性。假设Na2S2O3已完全反应,则证明盐水b中含有SO42-的方法是__________,观察到的现象是____________。
③有同学提出,该流程中的过程IV可直接加入NaOH溶液除去NH4+和Mg2+,你认为是否可行?_______(填“是”或“否”,提示NH3极易溶于水),理由是_______(答一点)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国科学院官方微信于2017年3月发表《灰霾专题》,提出灰霾中细颗粒物的成因,部分分析如下图所示。

(1)根据上图信息可以看出,下列哪种气体污染物不是由机动车行驶造成的_________,
a.SO2 b.NOx c.VOCs d. NH3
(2)机动车大量行驶是污染源之一。汽车发动机废气稀燃控制系统主要工作原理如图所示;写出稀燃过程中NO发生的主要反应的方程式_______。

(3)SO2是气体污染物的主要成分之一。作为一种化学性质活泼的物质,它能发生多种反应,请按照下表提示,从不同角度梳理SO2不同类的化学性质,将化学方程式填在下表中。
SO2性质梳理 | 化学方程式 | |
物质类别 | 酸性氧化物 | ①SO2 +H2O |
②SO2 + CaO = CaSO3 | ||
③_______________________ | ||
S元素 价态 | S为+4价 | ①_______________________ |
② SO2 + 2H2S = 3S + 2H2O | ||
(4)科学家经过研究发现中国霾呈中性,其主要原因如图所示:

请判断A的化学式并说明判断理由:______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com