
【题目】工业上利用铁的氧化物在高温条件下循环裂解水制氢气的流程如下图所示。

(1)反应I的化学方程式为:Fe3O4(s)+CO(g)![]() 3FeO(s)+CO2(g),反应Ⅱ的化学方程式为_________,对比反应I、Ⅱ,铁的氧化物在循环裂解水制氢气过程中的作用是_________。用化学方程式表示反应I、Ⅱ、Ⅲ的总结果:_________。
3FeO(s)+CO2(g),反应Ⅱ的化学方程式为_________,对比反应I、Ⅱ,铁的氧化物在循环裂解水制氢气过程中的作用是_________。用化学方程式表示反应I、Ⅱ、Ⅲ的总结果:_________。
(2)反应III为:CO2(g)+C(s)![]() 2CO(g)
2CO(g) ![]() H>0。为了提高达平衡后CO的产量,理论上可以采取的合理措施有_________(任写一条措施)。
H>0。为了提高达平衡后CO的产量,理论上可以采取的合理措施有_________(任写一条措施)。
(3)上述流程中铁的氧化物可用来制备含有Fe3+的刻蚀液,用刻蚀液刻蚀铜板时,可观察到溶液颜色逐渐变蓝,该反应的离子方程式为_________。刻蚀液使用一段时间后会失效,先加酸,再加入过氧化氢溶液,可实现刻蚀液中Fe3+的再生,该反应的离子方程式为_________。
(4)上述流程中碳的氧化物可用来制备碳酰肼[CO(NHNH2)2,其中碳元素为+4价]。加热条件下,碳酰肼能将锅炉内表面锈蚀后的氧化铁转化为结构紧密的四氧化三铁保护层,并生成氮气、水和二氧化碳。该反应的化学方程式为_________。
【答案】3FeO(s)+H2O(l) ![]() H2(g)+Fe3O4(s) 催化剂 C(s)+H2O(g)=CO(g)+H2(g)(方程不写状态,写可逆号亦可) 升高温度,减小压强,移走CO,加入CO2等 2Fe3++Cu=2Fe2++Cu2+ H2O2+2Fe2++2H+=2H2O+2Fe3+ CO(NHNH2)2+12Fe2O38Fe3O4+2N2↑+CO2↑+3H2O
H2(g)+Fe3O4(s) 催化剂 C(s)+H2O(g)=CO(g)+H2(g)(方程不写状态,写可逆号亦可) 升高温度,减小压强,移走CO,加入CO2等 2Fe3++Cu=2Fe2++Cu2+ H2O2+2Fe2++2H+=2H2O+2Fe3+ CO(NHNH2)2+12Fe2O38Fe3O4+2N2↑+CO2↑+3H2O
【解析】
(1)由流程图可获取化学反应的反应物和生成物相关信息,再结合原子守恒和电子守恒进行分析解答;
(2)反应III为:CO2(g)+C(s)![]() 2CO(g) ΔΗ>0,该反应正反应为一个气体分子数目增多的吸热反应,提高达平衡后CO的产量,则需要促使平衡正向移动,由化学平衡移动原理分析解答;
2CO(g) ΔΗ>0,该反应正反应为一个气体分子数目增多的吸热反应,提高达平衡后CO的产量,则需要促使平衡正向移动,由化学平衡移动原理分析解答;
(3)用刻蚀液刻蚀铜板时的反应为:2Fe3++Cu=2Fe2++Cu2+,刻蚀液中Fe3+的再生,即将亚铁离子氧化又生成铁离子,由此解答;
(4)由题给信息分析出该反应的反应物和生成物,再结合氧化还原反应方程式的配平方法可解答。
(1)由流程图可知反应II的反应物为FeO(s)和H2O(g),生成物为H2(g)和Fe3O4(s),配平可得方程式3FeO(s)+H2O(g)![]() H2(g)+Fe3O4(s);反应I为:Fe3O4(s)+CO(g)
H2(g)+Fe3O4(s);反应I为:Fe3O4(s)+CO(g) ![]() 3FeO(s)+CO2(g),反应II为:3FeO(s)+H2O(g)
3FeO(s)+CO2(g),反应II为:3FeO(s)+H2O(g)![]() H2(g)+Fe3O4(s),综合两反应可知铁的氧化物虽然参与了反应,但在反应前后并没有发生变化,起到催化剂的作用;由流程图可知,整个过程的反应物为C(s)和H2O(g),生成物为CO(g)和H2(g),则反应I、II、III的总结果为:C(s)+H2O(g)
H2(g)+Fe3O4(s),综合两反应可知铁的氧化物虽然参与了反应,但在反应前后并没有发生变化,起到催化剂的作用;由流程图可知,整个过程的反应物为C(s)和H2O(g),生成物为CO(g)和H2(g),则反应I、II、III的总结果为:C(s)+H2O(g)![]() CO(g)+H2(g);故答案为:3FeO(s)+H2O(g)
CO(g)+H2(g);故答案为:3FeO(s)+H2O(g) ![]() H2(g)+Fe3O4(s)、催化剂、C(s)+H2O(g)
H2(g)+Fe3O4(s)、催化剂、C(s)+H2O(g)![]() CO(g)+H2(g)(方程不写状态,写可逆号亦可) ;
CO(g)+H2(g)(方程不写状态,写可逆号亦可) ;
(2)反应III为:CO2(g)+C(s)![]() 2CO(g) ΔΗ>0,该反应正反应为一个气体分子数目增多的吸热反应,提高达平衡后CO的产量,则需要促使平衡正向移动,由化学平衡移动原理可知;在其它条件不变时,升高温度、减小压强、移走CO或加入CO2等都可使平衡正向移动,提高达平衡后CO的产量,故答案为:在其它条件不变时,升高温度、减小压强、移走CO或加入CO2等(任写一条措施);
2CO(g) ΔΗ>0,该反应正反应为一个气体分子数目增多的吸热反应,提高达平衡后CO的产量,则需要促使平衡正向移动,由化学平衡移动原理可知;在其它条件不变时,升高温度、减小压强、移走CO或加入CO2等都可使平衡正向移动,提高达平衡后CO的产量,故答案为:在其它条件不变时,升高温度、减小压强、移走CO或加入CO2等(任写一条措施);
(3)用刻蚀液刻蚀铜板时,可观察到溶液颜色逐渐变蓝,是因为生成了Cu2+,发生的离子反应为:2Fe3++Cu=2Fe2++Cu2+;在酸性条件下,双氧水可将Fe2+氧化生成Fe3+,从而实现刻蚀液的再生,发生的离子反应为:H2O2+2Fe2++2H+=2H2O+2Fe3+;故答案为:2Fe3++Cu=2Fe2++Cu2+;H2O2+2Fe2++2H+=2H2O+2Fe3+;
(4)由题给信息可知该反应的反应为:CO(NHNH2)2和Fe2O3,生成物有Fe3O4、N2、CO2、H2O等,由氧化还原反应的规律配平可得方程式CO(NHNH2)2+12Fe2O38Fe3O4+2N2↑+CO2↑+3H2O;故答案为:CO(NHNH2)2+12Fe2O8Fe3O4+2N2↑+CO2↑+3H2O。


 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案科目:高中化学 来源: 题型:
【题目】将下列晶体熔化:氢氧化钠、金刚石、硫化钾、干冰,需要克服的微粒间的相互作用①共价键②离子键③分子间作用力,正确的顺序是( )
A.①②②③B.②①②③C.②③②①D.①①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图所示装置测定中和热的实验步骤如下:
①用量筒量取50 mL 0.50 mol·L-1盐酸倒入小烧杯中,测出盐酸温度;②用另一量筒量取50 mL 0.55 mol·L-1NaOH溶液,并用另一温度计测出其温度;③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液温度。
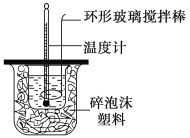
回答下列问题:
(1)倒入NaOH溶液的正确操作是________(填序号)。
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(2)使盐酸与NaOH溶液混合均匀的正确操作是________(填序号)。
A.用温度计小心搅拌
B.揭开泡沫塑料板用玻璃棒搅拌
C.轻轻地振荡烧杯
D.用套在温度计上的环形玻璃搅拌棒轻轻地上下搅动
(3)现将一定量的稀氢氧化钠溶液、稀氢氧化钙溶液、稀氨水分别和1 L 1 mol·L-1的稀盐酸恰好完全反应,其反应热分别为ΔH1、ΔH2、ΔH3,则ΔH1、ΔH2、ΔH3的大小关系为__________________。
(4)假设盐酸和氢氧化钠溶液的密度都是1 g·cm-3,又知中和反应后生成溶液的比热容c=4.18 J·g-1·℃-1。为了计算中和热,某学生记录数据如下:
实验序号 | 起始温度t1/ ℃ | 终止温度t2/ ℃ | |
盐酸 | 氢氧化钠溶液 | 混合溶液 | |
1 | 20.0 | 20.1 | 23.2 |
2 | 20.2 | 20.4 | 23.4 |
3 | 20.5 | 20.6 | 23.6 |
依据该学生的实验数据计算,该实验测得的中和热ΔH=________(结果保留一位小数)。
(5)________(填“能”或“不能”)用Ba(OH)2溶液和硫酸代替氢氧化钠溶液和盐酸,理由是____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.淀粉和纤维素互为同系物
B.水可以用来分离苯和苯酚的混合物
C.植物油氢化过程中发生了还原反应
D.环己烯与甲苯可用酸性KMnO4溶液鉴别
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上制汞的过程是:焙烧辰砂(主要含HgS),发生反应:HgS+O2![]() Hg+SO2还原出的汞呈气态,冷凝得液态汞。其流程如图,下列说法不正确的是
Hg+SO2还原出的汞呈气态,冷凝得液态汞。其流程如图,下列说法不正确的是
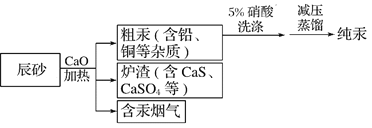
A. 洗涤粗汞时可用5%的盐酸代替5%的硝酸
B. HgS+O2![]() Hg+SO2属于置换反应
Hg+SO2属于置换反应
C. 含汞烟气必须处理达标后才能排放
D. 流程中加入氧化钙的目的是减少SO2的排放
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列比较中不正确的是
A.金属性:K > Na > Li
B.热稳定性:HI > HCl > HF
C.非金属性:F> O> N
D.碱性:NaOH > Mg(OH)2 > Al(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W均为常见的短周期主族元素,常温下,其最高价氧化物对应的水化物溶液(浓度均为 0.01mol/L)的pH和原子半径的关系如下图所示。其中,Y为碳元素。下列有关说法正确的是

A. X是硫元素
B. Y的最高价氧化物的电子式为 ![]()
C. W的最高价氧化物对应的水化物中仅含离子键
D. Z的最高价氧化物对应水化物的化学式为HClO4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com