
【题目】在密闭容器中,对可逆反应A+3B![]() 2C(g),平衡时C的体积分数与温度和压强的关系如图所示,下列判断错误的是
2C(g),平衡时C的体积分数与温度和压强的关系如图所示,下列判断错误的是
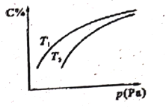
A.若正反应方向Q<0,则T1>T2
B.A可能为气体
C.压强增大时,混合气体的平均相对分子质量增大
D.B不一定为气体
科目:高中化学 来源: 题型:
【题目】有50mL NaOH溶液,向其中逐渐通入一定量的CO2,随后取此溶液10mL将其稀释到100mL,并向此稀释后的溶液中逐滴加入0.1mol/L的HCl溶液,产生的CO2气体体积(标准状况下)与所加入的HCl的体积之间的关系如图所示:
甲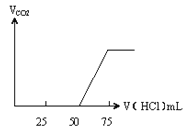 乙
乙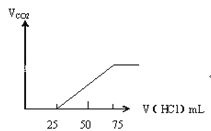
试
(1)NaOH在吸收CO2气体后,在甲、乙两种情况下,所得溶液中存在的溶质是甲:_____。
(2)乙情况下产生的CO2气体(标准状况)乙:______mL。
(3)原NaOH溶液的物质的量浓度是_____;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式:
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH=-24.8 kJ/mol
Fe2O3(s)+1/3CO(g)=2/3Fe3O4(s)+1/3CO2(g) ΔH=-15.73 kJ/mol
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) ΔH=+640.4 kJ/mol
则14 g CO气体还原足量FeO固体得到Fe单质和CO2气体时对应的ΔH约为( )
A.-218 kJ/molB.-109 kJ/molC.+109 kJ/molD.+218 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等物质的量浓度的CuSO4和NaCl等体积混合后,用石墨电极进行电解,电解过程中,溶液pH随时间t变化的曲线如图(不考虑电极产物的溶解),则下列说法正确的是( )
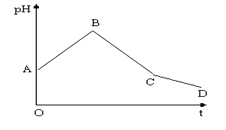
A.阳极产物一定是Cl2,阴极产物一定是Cu
B.整个过程中阳极先产生Cl2,后产生O2
C.BC段表示在阴极上是H+放电产生了H2
D.CD段表示阳极上OH-放电破坏了水的电离平衡,产生了H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知2A2(g)+B2(g)![]() 2C3(g) △H=-Q1 kJ/mol(Q1>0), 在一个有催化剂的容积不变的密闭容器中加入2 molA2和1 molB2,在500℃时充分反应,达平衡后C3的浓度为w mol·L-1,放出热量为Q2 kJ。
2C3(g) △H=-Q1 kJ/mol(Q1>0), 在一个有催化剂的容积不变的密闭容器中加入2 molA2和1 molB2,在500℃时充分反应,达平衡后C3的浓度为w mol·L-1,放出热量为Q2 kJ。
(1)达到平衡时, A2的转化率为____________。
(2)达到平衡后,若向原容器中通入少量的氩气,A2的转化率将______(填“增大“、“减小”或“不变”)
(3)恒压的密闭容器中发生可逆反应2A2(g)+B2(g)![]() 2C3(g) △H=-Q1 kJ/mol(Q1>0),在一定条件下达到化学平衡状态的标志是 (____)
2C3(g) △H=-Q1 kJ/mol(Q1>0),在一定条件下达到化学平衡状态的标志是 (____)
A. v(A2):v(C3)=3:2
B.反应混合气体的密度不再变化
C.反应混合气体的平均摩尔质量不再变化
D.A2、B2两种反应物的转化率不再变化
E. A2、B2、C3三种物质的浓度相等
F.密闭容器内的压强不再变化
(4)改变某一条件,得到如上图的变化规律(图中T表示温度,n表示物质的量),可得出的结论正确的是____;
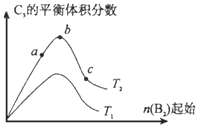
a.反应速率c>b>a
b.达到平衡时A2的转化率大小为:b>a>c
c.T2>T1
d.b点A2和B2的物质的量之比为2:1
(5)若将上述容器改为恒压容器,起始时加入2 molA2和1 molB2,500℃时充分反应达平衡后,放出热量Q4 kJ,则Q2_______Q4(填“>”、“<”或“=”)。
(6)下列措施可以同时提高反应速率和B2的转化率是_______(填选项序号)。
a.选择适当的催化剂 b.增大压强
c.及时分离生成的C3 d.升高温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国人自古就有泡药酒的习惯。药酒多选用50-60度的白酒,将中药材浸泡在酒中,经过一段时间,中药材中的有效成分(主要是有机物)溶解在酒中,此时即可过滤去渣后饮用。泡药酒的原理属于

A.萃取B.结晶C.干燥D.置换
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汾酒是山西特产,有着4000年左右的历史,被誉为“最早国酒”。酿酒的工艺流程如下:
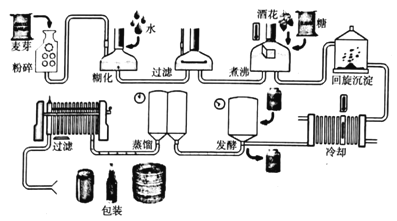
请回答下列问题:
(1)上述流程中用于混合物分离的操作名称是___。
(2)“粉碎”的目的是___,“发酵”过程中发生的反应的类型属于:___。
(3)如图是实验室进行蒸馏操作的装置图,仪器a的名称是___,冷凝水的进水口是___(填字母),为保证实验的安全,蒸馏操作中需注意的一项操作是____。
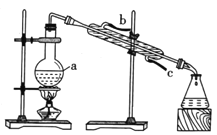
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲是一种盐,由A、B、C、D、E五种短周期元素元素组成。甲溶于水后可电离出三种离子,其中含有由A、B形成的10电子阳离子。A元素原子核内质子数比E的少1,D、E处于同主族。用甲进行如下实验:
①取少量甲的晶体溶于蒸馏水配成溶液;
③取少量甲溶液于试管中,向其中加入稀盐酸,再加入BaCl2溶液,出现白色沉淀;
③取少量甲溶液于试管中逐滴滴入NaOH溶液,生成沉淀的质量与滴入NaOH溶液的体积关系如下图所示,

④取少量甲溶液于试管中,加入过最的NaOH溶液并加热。
回答下列问题:
(1)C的元素符号是_______,D在周期表中的位置是________。
(2)经测定甲晶体的摩尔质量为453 gmol-1,其中阳离子和阴离子物质的量之比为1:1,则甲晶体的化学式为________。
(3)实验③中根据图象得V(oa):V(ab):V(bc)= _______。
(4)实验④中离子方程式是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于Na2CO3和 NaHCO3性质的说法正确的是( )
A.相同温度时,在水中的溶解度:NaHCO3>Na2CO3
B.与Ca(OH)2溶液反应:Na2CO3溶液中有白色沉淀生成,NaHCO3溶液中没有沉淀生成
C.热稳定性:NaHCO3>Na2CO3
D.相同物质的量浓度时,溶液的碱性:NaHCO3<Na2CO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com