
【题目】已知下列热化学方程式:
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH=-24.8 kJ/mol
Fe2O3(s)+1/3CO(g)=2/3Fe3O4(s)+1/3CO2(g) ΔH=-15.73 kJ/mol
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) ΔH=+640.4 kJ/mol
则14 g CO气体还原足量FeO固体得到Fe单质和CO2气体时对应的ΔH约为( )
A.-218 kJ/molB.-109 kJ/molC.+109 kJ/molD.+218 kJ/mol
科目:高中化学 来源: 题型:
【题目】向NaOH和Na2CO3混合溶液中滴加0.1mol/L稀盐酸,CO2的生成量与加入盐酸的体积(V)的关系如图所示.下列判断正确的是(
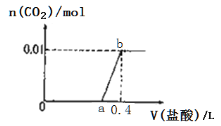
A. 在0~a范围内,只发生中和反应
B. 原混合溶液中NaOH与Na2CO3的物质的量之比为1:2
C. a = 0.3
D. ab段发生反应的离子方程式为:CO32-+2H+=H2O+CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA代表阿伏加德罗常数的值,下列说法正确的是( )
A.1 molNa在空气中完全燃烧,转移的电子数为2NA
B.常温下,2.7g铝与足量NaOH溶液反应,消耗0.1NA个水分子
C.0.1molFe与足量水蒸气反应生成H2的分子数为0.1NA
D.11.2LCl2含有的原子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通常工业上监测SO2含量是否达到排放标准的化学反应原理是SO2+ H2O2+ BaCl2= BaSO4↓+ 2HC1 ,用NA表示阿伏加德罗常数的值,下列说法不正确的是
A. 0.1 molBaCl2中所含离子总数约为0.3 NA
B. 25℃时,pH=l的HC1溶液中含有H+的数目约为0.1 NA
C. 标准状况下,17gH2O2中所含电子总数约为9 NA
D. 生成2.33gBaSO4沉淀时,吸收SO2的体积在标准状况下约为0.224L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上利用铁的氧化物在高温条件下循环裂解水制氢气的流程如下图所示。

(1)反应I的化学方程式为:Fe3O4(s)+CO(g)![]() 3FeO(s)+CO2(g),反应Ⅱ的化学方程式为_________,对比反应I、Ⅱ,铁的氧化物在循环裂解水制氢气过程中的作用是_________。用化学方程式表示反应I、Ⅱ、Ⅲ的总结果:_________。
3FeO(s)+CO2(g),反应Ⅱ的化学方程式为_________,对比反应I、Ⅱ,铁的氧化物在循环裂解水制氢气过程中的作用是_________。用化学方程式表示反应I、Ⅱ、Ⅲ的总结果:_________。
(2)反应III为:CO2(g)+C(s)![]() 2CO(g)
2CO(g) ![]() H>0。为了提高达平衡后CO的产量,理论上可以采取的合理措施有_________(任写一条措施)。
H>0。为了提高达平衡后CO的产量,理论上可以采取的合理措施有_________(任写一条措施)。
(3)上述流程中铁的氧化物可用来制备含有Fe3+的刻蚀液,用刻蚀液刻蚀铜板时,可观察到溶液颜色逐渐变蓝,该反应的离子方程式为_________。刻蚀液使用一段时间后会失效,先加酸,再加入过氧化氢溶液,可实现刻蚀液中Fe3+的再生,该反应的离子方程式为_________。
(4)上述流程中碳的氧化物可用来制备碳酰肼[CO(NHNH2)2,其中碳元素为+4价]。加热条件下,碳酰肼能将锅炉内表面锈蚀后的氧化铁转化为结构紧密的四氧化三铁保护层,并生成氮气、水和二氧化碳。该反应的化学方程式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaClO2是一中重要的杀菌消毒剂,也常用来漂白织物等,其一种生产工艺如图所示。请回答下列问题:
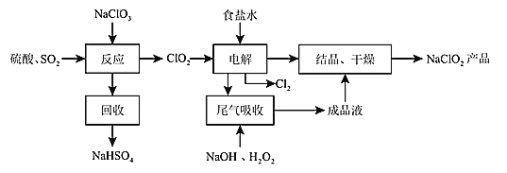
(1)NaClO2中Cl元素的化合价为_____________;
(2)写出“反应”步骤中生成ClO2的化学方程式________________________。
(3)“尾气吸收”步骤中发生的反应为2NaOH + H2O2 + 2ClO2 = 2NaClO2 + O2↑ + 2H2O ,其中氧化剂与还原剂的物质的量之比为_________;若有3 mol 电子发生转移,则有__________L(标准状况下)O2生成。
(4)“有效氯含量”可用来衡量含氯消毒剂的消毒能力,是指每克含氯消毒剂的氧化能力相当于多少克Cl2的氧化能力。则NaClO2的有效氯含量为_____(结果保留两位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一个容积为V的密闭容器,中间有一可自由滑动的隔板(厚度不计)将容器分成两部分,当左边充入1molN2,右边充入一定量的CO时,隔板处于如图位置(保持温度不变),下列说法正确的是( )
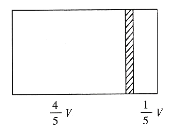
A.右边与左边分子数之比为4:1
B.右侧CO的质量为5.6g
C.右侧气体密度是相同条件下氢气密度的14倍
D.若改变右边CO的充入量而使隔板处于容器正中间,保持温度不变,则应充入0.2molCO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中,对可逆反应A+3B![]() 2C(g),平衡时C的体积分数与温度和压强的关系如图所示,下列判断错误的是
2C(g),平衡时C的体积分数与温度和压强的关系如图所示,下列判断错误的是
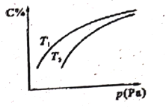
A.若正反应方向Q<0,则T1>T2
B.A可能为气体
C.压强增大时,混合气体的平均相对分子质量增大
D.B不一定为气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是重要的化工原料,又可作为燃料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
①CO(g)+2H2(g)![]() CH3OH(g)ΔH1
CH3OH(g)ΔH1
②CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)ΔH2
CH3OH(g)+H2O(g)ΔH2
③CO2(g)+H2(g)![]() CO(g)+H2O(g)ΔH3
CO(g)+H2O(g)ΔH3
回答下列问题:已知反应①中的相关的化学键键能数据如表:
化学键 | H—H | C—O |
| H—O | C—H |
E/(kJ·mol-1) | 436 | 343 | 1076 | 465 | 413 |
(1)由此计算ΔH1=__kJ·mol-1,已知ΔH2=-58kJ·mol-1,则ΔH3=__kJ·mol-1。
(2)在一定条件下,向2L恒容密闭容器中冲入1molCO2和3molH2发生反应②,5min时测得生成了0.4molH2O,求5min的反应速率v(H2)=__,写出一种能加快反应速率的措施___
(3)甲醇是电动汽车的理想燃料,工作原理如图所示:
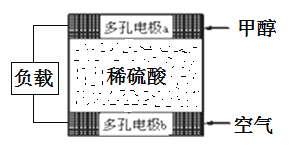
多孔电极b为燃料电池的__极(填“正”或“负”),多孔电极a发生的电极反应式为:____
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com