
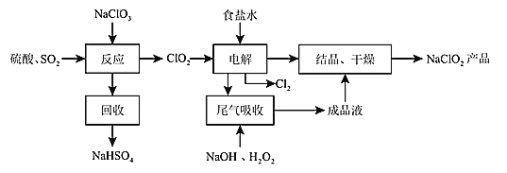
����Ŀ��NaClO2��һ����Ҫ��ɱ����������Ҳ������Ư��֯��ȣ���һ������������ͼ��ʾ����ش��������⣺
��1��NaClO2��ClԪ�صĻ��ϼ�Ϊ_____________��
��2��д������Ӧ������������ClO2�Ļ�ѧ����ʽ________________________��
��3����β�������������з����ķ�ӦΪ2NaOH + H2O2 + 2ClO2 = 2NaClO2 + O2�� + 2H2O �������������뻹ԭ�������ʵ���֮��Ϊ_________������3 mol ���ӷ���ת�ƣ�����__________L����״���£�O2���ɡ�
��4������Ч�Ⱥ���������������������������������������ָÿ�˺��������������������൱�ڶ��ٿ�Cl2��������������NaClO2����Ч�Ⱥ���Ϊ_____�����������λС������
���𰸡�+3 2NaClO3 + SO2 + H2SO4 = 2ClO2 + 2NaHSO4 2:1 33.6 1.57
��������
������ͼ��֪��NaClO3��SO2��H2SO4�ữ����������ClO2��NaHSO4����NaCl��Һ�м���ClO2�����е��ʱClO2�������õ�������ClO2-��Cl-������ʧ��������Cl2�����ú��й��������NaOH��Һ����δ�������ClO2���壬��Ӧ����NaClO2��O2��H2O��NaClO2��Һ�ᾧ������õ�NaClO2��Ʒ��
��1����NaClO2��NaΪ+1�ۣ�OΪ-2�ۣ������������ϼ۵Ĵ�����Ϊ0���ɵ�Cl�Ļ��ϼ�Ϊ+3�ۣ��ʴ�Ϊ��+3��
��2��NaClO3��SO2��H2SO4�ữ����������ClO2������NaClO2������������ԭ����ΪNaCl�����ݵ�ʧ�����غ��ԭ���غ㣬�˷�Ӧ�Ļ�ѧ����ʽΪ2NaClO3+SO2+H2SO4=2ClO2+2NaHSO4���ʴ�Ϊ��2NaClO3+SO2+H2SO4=2ClO2+2NaHSO4��
��3���ɷ�Ӧ����ʽ��֪����1mol��������Ӧ��ת��2mol���ӣ��������ͻ�ԭ�������ʵ���֮��Ϊ2:1��������3 mol ���ӷ���ת�ƣ���Ӧ�������������ʵ���Ϊ1.5mol�����Ϊ1.5mol��22.4L/mol=33.6L���ʴ�Ϊ��2:1��33.6��
��4��ÿ��NaClO2�����ʵ���n(NaClO2)=![]() =
=![]() mol����õ��ӵ����ʵ�����n(e)Ϊ
mol����õ��ӵ����ʵ�����n(e)Ϊ![]() mol��4��1 mol Cl2��õ��ӵ����ʵ�����2 mol�����ݵ���ת����Ŀ��ȣ���֪����������������ʵ���Ϊ
mol��4��1 mol Cl2��õ��ӵ����ʵ�����2 mol�����ݵ���ת����Ŀ��ȣ���֪����������������ʵ���Ϊ![]() mol��4��
mol��4��![]() =
=![]() mol��������������Ϊ
mol��������������Ϊ![]() mol��71 g/mol=1.57 g��NaClO2����Ч�Ⱥ���Ϊ1.57���ʴ�Ϊ��1.57��
mol��71 g/mol=1.57 g��NaClO2����Ч�Ⱥ���Ϊ1.57���ʴ�Ϊ��1.57��


 ѧҵ����һ��һ��ϵ�д�
ѧҵ����һ��һ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
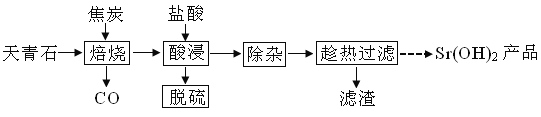
����Ŀ������������ζ����֮�ơ�������ʯ����Ҫ����SrSO4������CaCO3��MgO���ʣ������������ȵĹ������£�
��֪����������ˮ�е��ܽ�ȣ�
�¶ȣ��棩 | 0 | 10 | 20 | 30 | 40 | 60 | 80 | 90 | 100 |
�ܽ�ȣ�g/100mL�� | 0.91 | 1.25 | 1.77 | 2.64 | 3.95 | 8.42 | 20.2 | 44.5 | 91.2 |
��1��������������ʱSrSO4ֻ����ԭ��SrS����ѧ����ʽΪ____��
��2��������������������Һ������95������NaOH��Һ����pHΪ12��
��95��ʱˮ�����ӻ�KW��1.0��10��12��Ksp[Mg(OH)2]��1.2��10��10������Һ��c��Mg2������____��
����pH���������������ȵIJ��ʽ��ͣ������ԭ��____��
��3�������ȹ�������Ŀ����____��������������Ҫ�ɷ�Ϊ___��
��4���ӳ��ȹ��˺����Һ�еõ�Sr(OH)2��Ʒ�IJ���Ϊ____�����ˡ�ϴ�ӡ����
��5������������������FeCl3��Һ����������������壬����ʱ����������Ϊ___���ѧʽ��������ʯī�缫�������Һ�������������������ѭ�����õ�������__��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й���̼���ƺ�̼�����ƵıȽ��в���ȷ����(����)
A.������ˮ�е��ܽ�Ȳ�ͬ��̼�����Ƶ��ܽ��С��̼����
B.�������ȶ��Բ�ͬ��̼���Ƶ����ȶ��Դ���̼������
C.���߶��������ᷴӦ�ų�������̼���壬������ʱ����CO2��һ����
D.������һ�������¿����ת��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͨ�����ǰѲ�1 molij��ѧ�������յ��������ɸû�ѧ���ļ��ܣ����ܵĴ�С�����ڹ��㻯ѧ��Ӧ�ķ�Ӧ��(��H)����ѧ��Ӧ����H���ڷ�Ӧ�ж��Ѿɻ�ѧ���ļ���֮���뷴Ӧ���γ��»�ѧ���ļ���֮�͵IJ�.
��ѧ�� | H��H | Cl��Cl | H��Cl |
����1 mol��ѧ��ʱ�ų������� | 436 kJ/mol | 243 kJ/mol | 431 kJ/mol |
�������Ȼ�ѧ����ʽ����ȷ���� (����)
A.1/2H2(g)��1/2Cl2(g)===HCl(g)��H����91.5 kJ/mol
B.H2(g)��Cl2(g)===2HCl(g)����H����183 kJ/mol
C.2HCl(g)===H2(g)��Cl2(g)����H����183 kJ/mol
D.1/2H2(g)��1/2Cl2(g)===HCl(g)��H����91.5 kJ/mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪�����Ȼ�ѧ����ʽ��
Fe2O3(s)��3CO(g)=2Fe(s)��3CO2(g) ��H����24.8 kJ/mol
Fe2O3(s)��1/3CO(g)=2/3Fe3O4(s)��1/3CO2(g) ��H����15.73 kJ/mol
Fe3O4(s)��CO(g)=3FeO(s)��CO2(g) ��H����640.4 kJ/mol
��14 g CO���廹ԭ����FeO����õ�Fe���ʺ�CO2����ʱ��Ӧ����HԼΪ(����)
A.��218 kJ/molB.��109 kJ/molC.��109 kJ/molD.��218 kJ/mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ�������ֵ��������������ȷ����
A.31g���������P-P������NA
B.22.4LSO2����NA��SO2����
C.��״���£���������NO2��N2O4������ԭ�Ӹ������
D.1molCl2ͨ���ȵ�NaOH��Һ�У�������NaCl��NaClO3������ַ�Ӧ��ת�Ƶĵ�����ΪNA��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʵ���Ũ�ȵ�CuSO4��NaCl�������Ϻ���ʯī�缫���е�⣬�������У���ҺpH��ʱ��t�仯��������ͼ�������ǵ缫������ܽ⣩��������˵����ȷ���ǣ� ��
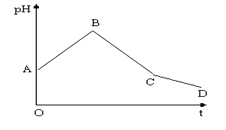
A.��������һ����Cl2����������һ����Cu
B.���������������Ȳ���Cl2�������O2
C.BC�α�ʾ����������H+�ŵ������H2
D.CD�α�ʾ������OH-�ŵ��ƻ���ˮ�ĵ���ƽ�⣬������H+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���й����Թž�����ҩ�Ƶ�ϰ�ߡ�ҩ�ƶ�ѡ��50-60�ȵİƣ�����ҩ�Ľ����ھ��У�����һ��ʱ�䣬��ҩ���е���Ч�ɷ֣���Ҫ���л���ܽ��ھ��У���ʱ���ɹ���ȥ�������á���ҩ�Ƶ�ԭ������

A.��ȡB.�ᾧC.����D.�û�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
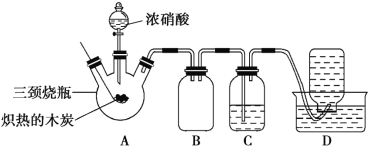
����Ŀ��ij��ѧѧϰС���������װ�ã���Ũ������ľ̿�ķ�Ӧ����̽����
��֪��4HNO3![]() 4NO2����O2����2H2O
4NO2����O2����2H2O
��ش��������⣺
��1�����װ�������Ժ�ȼ�ճ��е�ľ̿�ھƾ����ϼ���������״̬����������������ƿ�У�������ƿ�����μ�Ũ���ᣬ�ɹ۲쵽������ƿ���������ɫΪ____���������������Ҫ��ѧ��Ӧ����ʽ��_____��
��2��װ��C��ʢ������Ba(OH)2��Һ����Ӧһ��ʱ���ɹ۲쵽C�г��ְ�ɫ�������ð�ɫ����Ϊ____(�ѧʽ)�����е�Ba(OH)2��Һ___(������������������)��Ca(OH)2��Һ���棬������_____��
��3��װ��B��������___��
��4��װ��D���ռ�������ɫ���壬����ͬѧ��Ϊ��NO�����в���ͬѧ��Ϊ��O2��
�����жԸ�����ļ��鷽�����ʵ���__(�����)��
A�����ڹ۲켯��ƿ���������ɫ�仯
B������ʪ����ɫʯ����ֽ���뼯��ƿ�ڣ��۲���ֽ�Ƿ���
C���������ǵ�ľ�����뼯��ƿ�У��۲�ľ���Ƿ�ȼ
���������ƿ���ռ�������ɫ����������������������Դ��____��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com