
����Ŀ���й���ѧԺ�ٷ�����2017��3�·���������ר�⡷�����������ϸ������ij����ַ�������ͼ��ʾ��

(1)������ͼ��Ϣ���Կ�������������������Ⱦ�������ɻ�������ʻ��ɵ�_________,
a��SO2 b��NOx c��VOCs d�� NH3
(2)������������ʻ����ȾԴ֮һ����������������ϡȼ����ϵͳ��Ҫ����ԭ����ͼ��ʾ��д��ϡȼ������NO��������Ҫ��Ӧ�ķ���ʽ_______��

(3)SO2��������Ⱦ�����Ҫ�ɷ�֮һ����Ϊһ�ֻ�ѧ���ʻ��õ����ʣ����ܷ������ַ�Ӧ���밴���±���ʾ���Ӳ�ͬ�Ƕ�����SO2��ͬ��Ļ�ѧ���ʣ�����ѧ����ʽ�����±��С�
SO2�������� | ��ѧ����ʽ | |
������� | ���������� | ��SO2 +H2O |
��SO2 + CaO = CaSO3 | ||
��_______________________ | ||
SԪ�� ��̬ | SΪ+4�� | ��_______________________ |
�� SO2 + 2H2S = 3S + 2H2O | ||
(4)��ѧ�Ҿ����о������й��������ԣ�����Ҫԭ����ͼ��ʾ��

���ж�A�Ļ�ѧʽ��˵���ж����ɣ�______________________��
���𰸡�a 2NO+O2=2NO2 SO2+2NaOH��Na2SO3+H2O 2SO2+O2![]() 2SO3 SO42- ����Ϊ��Ӧ֮ǰSΪ+4�ۣ�NΪ+4�ۣ���Ӧ֮��HONO��NԪ�صļ�̬Ϊ+3�ۣ���Ԫ�ػ��ϼ۽��ͣ�����Ԫ�ػ��ϼ����ߣ��ۺ��ƶϣ�Ӧ��SԪ�ػ��ϼ����ߣ���+4���ߵ�+6�ۣ���Һ��Ӧ��SO42-��ʽ����
2SO3 SO42- ����Ϊ��Ӧ֮ǰSΪ+4�ۣ�NΪ+4�ۣ���Ӧ֮��HONO��NԪ�صļ�̬Ϊ+3�ۣ���Ԫ�ػ��ϼ۽��ͣ�����Ԫ�ػ��ϼ����ߣ��ۺ��ƶϣ�Ӧ��SԪ�ػ��ϼ����ߣ���+4���ߵ�+6�ۣ���Һ��Ӧ��SO42-��ʽ����
��������
��1����ͼ��֪SO2�����ɻ�������ʻ��ɵ���
��2��ϡȼ������NO��������������NO2��
��3��SO2���������������Ӧ�����κ�ˮ��SO2��SԪ��Ϊ+4�ۣ��м��+4��SԪ�ؼȿ��Եõ����ӷ�����ԭ��Ӧ��Ҳ����ʧȥ���ӷ���������Ӧ��
��4����Ӧ֮ǰSΪ+4�ۣ�NΪ+4�ۣ���Ӧ֮��HONO��NԪ�صļ�̬Ϊ+3�ۣ���Ԫ�ػ��ϼ۽��ͣ�����Ԫ�ػ��ϼ����ߣ�SԪ�ػ��ϼ�������
��1��������ͼ��Ϣ���Կ�����������ʻ��ɵ���Ⱦ��NOx��VOCs��NH3��SO2�����ɻ�������ʻ��ɵģ���ѡa���ʴ�Ϊ��a��
��2��ϡȼ������NO��������������NO2����������Ҫ��Ӧ�ķ���ʽΪ2NO+O2=2NO2���ʴ�Ϊ��2NO+O2=2NO2��
��3��SO2���������������Ӧ�����κ�ˮ����Ӧ�Ļ�ѧ����ʽΪ��SO2+2NaOH��Na2SO3+H2O��SO2��SԪ��Ϊ+4�ۣ��м��+4��SԪ�ؼȿ��Եõ����ӷ�����ԭ��Ӧ��Ҳ����ʧȥ���ӷ���������Ӧ������������Ӧ�ķ���ʽΪ��2SO2+O2![]() 2SO3���ʴ�Ϊ��SO2+2NaOH��Na2SO3+H2O��2SO2+O2
2SO3���ʴ�Ϊ��SO2+2NaOH��Na2SO3+H2O��2SO2+O2![]() 2SO3��
2SO3��
��4����Ϊ��Ӧ֮ǰSΪ+4�ۣ�NΪ+4�ۣ���Ӧ֮��HONO��NԪ�صļ�̬Ϊ+3�ۣ���Ԫ�ػ��ϼ۽��ͣ�����Ԫ�ػ��ϼ����ߣ��ۺ��ƶϣ�Ӧ��SԪ�ػ��ϼ�������SԪ�ش�+4���ߵ�+6�ۣ���Һ��Ӧ��SO42-��ʽ���ڣ�����A�Ļ�ѧʽΪSO42-���ʴ�Ϊ��SO42- ����Ϊ��Ӧ֮ǰSΪ+4�ۣ�NΪ+4�ۣ���Ӧ֮��HONO��NԪ�صļ�̬Ϊ+3�ۣ���Ԫ�ػ��ϼ۽��ͣ�����Ԫ�ػ��ϼ����ߣ��ۺ��ƶϣ�Ӧ��SԪ�ػ��ϼ����ߣ���+4���ߵ�+6�ۣ���Һ��Ӧ��SO42-��ʽ������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������X����(�����)Y��Һ�У������ɳ��������ʵ��������X�����ʵ�����ϵ��ͼ��ʾ������ͼʾ�������( )
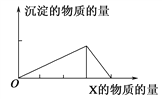
A | B | C | D | |
X | NaOH | HCl | CO2 | AlCl3 |
Y | AlCl3 | NaAlO2 | Ca(OH)2 | NaOH |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��Һ��ֻ���ܺ���K+��NH4+��Fe2+��Al3+��Cl����SO42����CO32����AlO2�� �е����������ӣ�����Ũ�Ⱦ�Ϊ 0.1molL��1��ijͬѧ����������ʵ�飺

����˵����ȷ���ǣ� ��
A. ��ȷ��ԭ��Һ���Ƿ��� Al3+�� Cl��
B. ��Һ X �д������ڵ��������� NH4+�� Fe2+�� Ba2+
C. ��ȷ������ C �ijɷ�
D. ԭ��Һ�д��ڵ�����Ϊ NH4+�� Fe2+�� Cl���� SO42��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ˮMgBr2������������ʵ���Ҳ���þм��Һ��Ϊԭ���Ʊ���ˮMgBr2��װ����ͼ����Ҫ�������£�
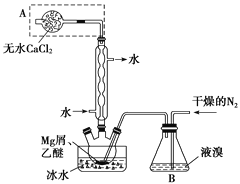
����1 ����ƿ��װ��10 gþм��150 mL��ˮ���ѣ�װ��B�м���15 mLҺ�塣
����2 ����ͨ�����ĵ�����ֱ������ȫ��������ƿ�С�
����3 ��Ӧ��Ϻ�ָ������£����ˣ���Һת������һ�������ƿ�У���ȴ��0 �棬�������壬�ٹ��˵������Ѻ��廯þ��Ʒ��
����4 �������ñ��ܽ��Ʒ����ȴ��0 �棬�������壬���ˣ�ϴ�ӵ������Ѻ��廯þ��������160 ��ֽ����ˮMgBr2��Ʒ��
��֪��
��Mg��Br2��Ӧ���ҷ��ȣ�MgBr2����ǿ��ˮ�ԣ�
��MgBr2��3C2H5OC2H5![]() MgBr2��3C2H5OC2H5��
MgBr2��3C2H5OC2H5��
��ش�
��1������A��������________��ʵ���в����ø�������������N2��ԭ����__________��
��2���罫װ��B��Ϊװ��C(��ͼ)�����ܻᵼ�µĺ����______________________��
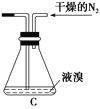
��3������3�У���һ�ι��˳�ȥ��������________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ������ ��
A. ���������Һ�ⶨNaOH��ҺŨ�ȵζ�ʵ���У��ζ�ǰ�����ݶ��ζ��������ݣ���ʹ�ⶨֵƫ��
B. �����¸ֹ���ֱ����Դ���������������������ֹ�
C. ��֪��101KPa�£�1gH2ȼ������ˮ�����ų�121kJ���������Ȼ�ѧ����ʽΪ��2H2(g)+O2(g)=2H2O(g)��H=-484kJ��mol-1
D. 25�棬101kPaʱ��ǿ����ǿ���ϡ��Һ�����кͷ�Ӧ���к���Ϊ57.3kJ��mol-1,��ʾϡH2SO4��KOH��Һ��Ӧ���к��ȵ��Ȼ�ѧ����ʽΪ��H2SO4(aq)+2KOH(aq)=K2SO4(aq)+2H2O(l)��H=-114.6kJ��mol-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪25�� ʱ��������ĵ��볣���� ����(CH3COOH)��1.75��10-5������(HCN) ��6.2��10-10�������(HF)��7.2��10-4,����(HCOOH)�� 1.77��10-4������˵������ȷ������ ��
A. ���ʵ���Ũ�Ⱦ�Ϊ0.1mol��L-1��������Һ������ǿ���ǣ������
B. ���ʵ���Ũ�Ⱦ�Ϊ0.1mol��L-1��CH3COONa��NaF��Һ�У�CH3COOH ��Ũ�ȴ���HF��Ũ�ȣ�NaF��Һ��pH��CH3COONa��Һ��
C. 0.1mol��L-1��HCN��NaCN��Һ�������ϵ���Һ�У�c(CN-)+)
D. ��Ũ�ȵ�NaCN ��HCOONa �����Һ�У�c(OH-)=c(H+)+c(HCN)+c(HCOOH)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������Ni2O3����һ����Ҫ�ĵ���Ԫ�����Ϻ����ز��ϡ���ҵ�����ú������ϣ����������ơ�þ�Ͻ�Ϊ������ȡ��������NiC2O4��2H2O�����ٸ������ղ�������ȡ��������������֪����ĸơ�þ�����ξ�������ˮ����������ͼ��ͼ��ʾ��
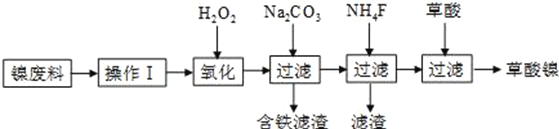
��ش��������⣺
��1��������Ϊ__________________________��
��2��������H2O2��������Ҫ��Ӧ�����ӷ���ʽΪ_____________________________��
������̼������ҺĿ���ǵ���Һ��pHֵ��4.0��5.0���û�ѧ����ش����̼���Ƶ�Ŀ��_________________________________________________________________��
��3����������NiC2O4��2H2O�����ȿ����и�����ˮ���ڸ��������գ����Ƶ�Ni2O3��ͬʱ��û�����壬NiC2O4���ȷֽ�Ļ�ѧ����ʽΪ___________________________________��
��4�������������֤��������ȫ______________________________________________��
����NiC2O4����ʱ���ϴ�ӳ���_________________________________________________��
��5����Al��NiO(OH)Ϊ�缫��NaOH��ҺΪ���Һ���һ�����͵�أ��ŵ�ʱNiO(OH)ת��ΪNi(OH)2����õ�ظ����ĵ缫��ӦʽΪ__________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijʵ��С��������ͼ����װ�ý���������ˮ������Ӧ����ʵ�飬�����ò����һ����ȡFeCl36H2O����(ͼ�мгּ�β������װ�þ�����ȥ)����ش��������⣺
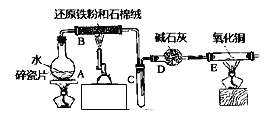
(1)װ��B�з�����Ӧ�Ļ�ѧ����ʽ��______________________________��
(2)E�г��ֵ�������______________________��
(3)��С���B�з�Ӧ��IJ�����뵽�����������У��ø���Һ��ȡFeCl36H2O���壮
����������Һ�к���Fe3+��ѡ�õ��Լ�Ϊ________________��������_______________��
�ڸ�ʵ��С��ͬѧ�������Լ�û�м�Fe3+�������ӷ���ʽ������Һ�в�����Fe3+���ܵ�ԭ��_______________________��
�۽�����Һ��FeCl2��ȫ����ΪFeCl3���ѡ�����������е�_______��
A������KMnO4��Һ B��Cl2 C��Na2O2 D��FeCl3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1��H3PO2��һԪ��ǿ�ᣬд������뷽��ʽ_______________________________��NaH2PO2Ϊ__________������������������ʽ������������Һ��__________��������������������������������������
��2���±��г���ij�������ŷŵķ�ˮ�и��ɷֵĺ��������һ�����ֵ���й����ݣ�
������п��ˮˮ�� | ���������ˮ���һ�����ֵ | |
Zn2+Ũ��/��mg��L-1�� | ��800 | ��3.9 |
pH | 1��5 | 6��9 |
SO42-Ũ��/��mg��L-1�� | ��23000 | ��150 |
��ijһ���մ�����ķ�ˮpH��8�������£��÷�ˮ��Zn2+��Ũ��Ϊ__________mg��L-1(�����£�Ksp[Zn(OH)2]��1.2��10-17)��__________(����������������������)���һ�������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com