
【题目】某试液中只可能含有K+、NH4+、Fe2+、Al3+、Cl﹣、SO42﹣、CO32﹣、AlO2﹣ 中的若干种离子,离子浓度均为 0.1molL﹣1.某同学进行了如下实验:

下列说法正确的是( )
A. 无法确定原试液中是否含有 Al3+、 Cl﹣
B. 滤液 X 中大量存在的阳离子有 NH4+、 Fe2+和 Ba2+
C. 无法确定沉淀 C 的成分
D. 原溶液中存在的离子为 NH4+、 Fe2+、 Cl﹣、 SO42﹣
 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】认真观察下列装置,回答下列问题:

(1)装置B中PbO2上发生的电极反应方程式为__________________。
(2)装置A中总反应的离子方程式为____________________________。
(3)装置D中总反应的离子方程式为_____________________________。
(4)若装置E的目的是在Cu材料上镀银,则X为________,极板N的材料为__________。
(5)当装置A中Cu电极质量改变6.4 g时,装置D中产生的气体体积为____L(标准状况下)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所示各装置设计一个实验,验证浓硫酸与木炭粉在加热条件下反应产生的各种产物。

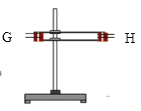
(1)如按气流由左向右流向,连接上述装置的正确顺序是(填各接口字母):
A接G,H接C,D接_______,_______接C,D接B ;
(2)仪器乙、丙应有怎样的实验现象才表明已检验出CO2?乙中_____________________________,丙中_____________________________;
(3)丁中酸性KMnO4溶液的作用是___________________________________________;
(4)写出甲中反应的化学方程式_________________________________________ 。
(5)硫酸有很多的性质,将下列性质对应的字母填入各小题后面对应的括号中:
A.脱水性 B.酸性 C.强氧化性 D.吸水性
Ⅰ.在化学实验中,浓硫酸可做SO2、CO2等气体的干燥剂。 (_______)
Ⅱ.Na2CO3与H2SO4反应,可生成Na2SO4和CO2。 (_______)
Ⅲ.向滤纸上滴加浓H2SO4 ,滤纸变黑。 (_______)
Ⅳ.在冷浓H2SO4中放入铁片没明显现象 (_______)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验或操作方法正确的是
A. 用蘸有待测液的铁丝,检验K+ 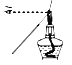
B. 从食盐水中提取氯化钠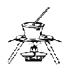
C. 验证NaHCO3和Na2CO3的热稳定性 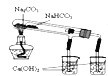
D. 分离水与乙醇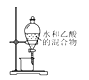
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列溶液中,各组离子一定能够大量共存的是( )
A. 能使广范pH试纸显红色的溶液:K+、Ba2+、Cl-、Br-
B. 含有大量Al3+的溶液:Na+、Cl-、HCO3-、SO42-
C. 能使淀粉碘化钾试纸显蓝色的溶液:K+、![]() 、S2-、SO32-
、S2-、SO32-
D. 常温下![]() =1012的溶液:Fe2+、Mg2+、NO3-、Cl-
=1012的溶液:Fe2+、Mg2+、NO3-、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠(NaNO2)是一种重要的工业盐,也常用于鱼类、肉类等食品的染色和防腐,易溶于水,微溶于乙醇. 某化学兴趣小组对亚硝酸钠进行多角度探究:
i.亚硝酸钠的制备
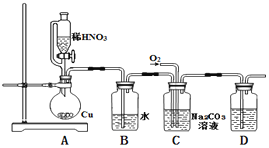
(1)实验中用恒压滴液漏斗,相比普通分液漏斗,显著的优点是____.
(2)D中澄清石灰水变浑浊,则C中制备NaNO2的离子方程式为_______________。
ii. 探究亚硝酸钠与硫酸反应气体产物成分.
已知:①NO+NO2+2OH﹣═2NO2﹣+H2O ②气体液化的温度:NO2:21℃,NO:﹣152℃

(3)反应前应打开弹簧夹,先通入一段时间氮气,目的是___________.
(4)为了检验装置A中生成的气体产物,仪器的连接顺序(按左→右连接):
A、C、______、______、______.
(5)在关闭弹簧夹,打开分液漏斗活塞,滴入70%硫酸后,A中产生红棕色气体.
①确认A中产生的气体含有NO,依据的现象是_________________.
②装置B的作用是____________________.
iii. 设计实验证明酸性条件下NaNO2具有氧化性:___________。
供选用的试剂:NaNO2溶液、KMnO4溶液、FeSO4溶液、KI溶液、稀硫酸、淀粉溶液、KSCN溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知0.1 mol/L的氨水溶液中存在电离平衡:NH3·H2O![]() NH4++OH-,对于该平衡,下列叙述正确的是
NH4++OH-,对于该平衡,下列叙述正确的是
A. 加入水时,平衡向逆反应方向移动
B. 加入少量NaOH固体,平衡向正反应方向移动
C. 加入少量0.1 mol/LHCl溶液,溶液中c(OH-)减小
D. 加入少量NH4Cl固体,平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国科学院官方微信于2017年3月发表《灰霾专题》,提出灰霾中细颗粒物的成因,部分分析如下图所示。

(1)根据上图信息可以看出,下列哪种气体污染物不是由机动车行驶造成的_________,
a.SO2 b.NOx c.VOCs d. NH3
(2)机动车大量行驶是污染源之一。汽车发动机废气稀燃控制系统主要工作原理如图所示;写出稀燃过程中NO发生的主要反应的方程式_______。

(3)SO2是气体污染物的主要成分之一。作为一种化学性质活泼的物质,它能发生多种反应,请按照下表提示,从不同角度梳理SO2不同类的化学性质,将化学方程式填在下表中。
SO2性质梳理 | 化学方程式 | |
物质类别 | 酸性氧化物 | ①SO2 +H2O |
②SO2 + CaO = CaSO3 | ||
③_______________________ | ||
S元素 价态 | S为+4价 | ①_______________________ |
② SO2 + 2H2S = 3S + 2H2O | ||
(4)科学家经过研究发现中国霾呈中性,其主要原因如图所示:

请判断A的化学式并说明判断理由:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
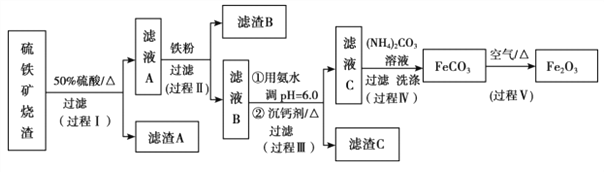
【题目】某课题组以硫铁矿烧渣(含 Fe2O3、 Fe3O4、 Al2O3、 CaO、 SiO2 等)为原料制取软磁用 Fe2O3(要求纯度>99.2%, CaO 含量<0.01%)。其工艺流程如下(所加入试剂均稍过量):
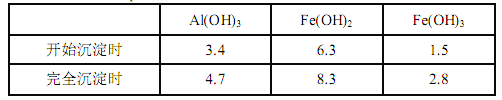
已知:生成氢氧化物的 pH 如下表所示
(1)滤渣 A 的主要成分是__________。
(2)在过程Ⅱ中可观察到产生少量气泡,溶液颜色慢慢变浅。能解释该实验现象的离子方程式有__________。
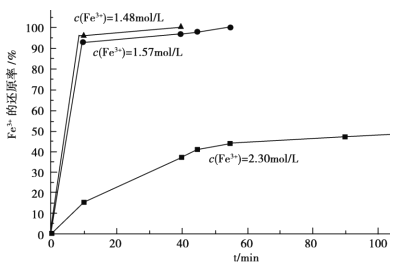
(3)在过程Ⅱ中,课题组对滤液 A 稀释不同倍数后,加入等质量的过量铁粉,得出 Fe3+浓度、还原率和反应时间的关系如图所示:结合上述实验结果说明:课题组选择稀释后c(Fe3+)为 1.60mol/L 左右的理由是______。
(4)在过程Ⅲ中,课题组在相同条件下,先选用了不同沉钙剂进行实验,实验数据见下表:(已知:滤液 B 中钙的含量以 CaO 计为 290—310mg/L)
沉钙剂 | Na2SO3 | H2C2O4 | (NH4)2CO3 | Na2CO3 | NH4F |
用量/g | 2 | 2 | 2 | 5 | 2 |
剩余CaO/mg/L) | 290 | 297 | 290 | 190 | 42 |
根据实验结果, 选择适宜的沉钙剂,得到滤渣 C 的主要成分有__________。
(5)在过程Ⅳ中,反应温度需要控制在 35℃以下,不宜过高,其可能的原因是__________。
(6)在过程Ⅴ中,反应的化学方程式是__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com