
【题目】下列说法正确的是( )
A. 用盐酸标准溶液测定NaOH溶液浓度滴定实验中,滴定前无气泡而滴定后有气泡,会使测定值偏高
B. 将地下钢管与直流电源的正极相连,用来保护钢管
C. 已知在101KPa下,1gH2燃烧生成水蒸气放出121kJ热量,其热化学方程式为:2H2(g)+O2(g)=2H2O(g)△H=-484kJ·mol-1
D. 25℃,101kPa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3kJ·mol-1,表示稀H2SO4与KOH溶液反应的中和热的热化学方程式为:H2SO4(aq)+2KOH(aq)=K2SO4(aq)+2H2O(l)△H=-114.6kJ·mol-1
【答案】C
【解析】A. 用盐酸标准溶液测定NaOH溶液浓度滴定实验中,滴定前无气泡而滴定后有气泡,则消耗标准盐酸体积的读数偏小,会使测定值偏低,A不正确;B. 将地下钢管与直流电源的正极相连,则钢管的腐蚀加快,不能用来保护钢管,B不正确;C. 已知在101KPa下,1gH2燃烧生成水蒸气放出121kJ热量,由此可以求出,在此条件下,4gH2燃烧生成水蒸气放出484kJ热量,所以,其热化学方程式为2H2(g)+O2(g)=2H2O(g)△H=-484kJ·mol-1,C正确;D. 25℃,101kPa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3kJ·mol-1,表示稀H2SO4与KOH溶液反应的中和热的热化学方程式为:![]() H2SO4(aq)+KOH(aq)=
H2SO4(aq)+KOH(aq)=![]() K2SO4(aq)+H2O(l) △H=-57.3kJ·mol-1,D不正确。
K2SO4(aq)+H2O(l) △H=-57.3kJ·mol-1,D不正确。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某企业以辉铜矿为原料生产碱式碳酸铜,工艺流程如下所示:

已知:[Cu(NH3)4]2+(aq) ![]() Cu2+(aq) + 4NH3(aq)根据以上工艺流程,下列说法不正确的是
Cu2+(aq) + 4NH3(aq)根据以上工艺流程,下列说法不正确的是
A.气体X中含有SO2
B.为实现溶液C到溶液D的转化,加NH3·H2O至红棕色沉淀刚好完全,过滤即可
C.蒸氨过程发生总反应的化学方程式为:[Cu(NH3)4 ]Cl2 + H2O![]() CuO + 2HCl↑+ 4NH3↑
CuO + 2HCl↑+ 4NH3↑
D.在制备产品时,溶液D中不直接加入Na2CO3溶液的原因是游离的Cu2+浓度太低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列溶液中,各组离子一定能够大量共存的是( )
A. 能使广范pH试纸显红色的溶液:K+、Ba2+、Cl-、Br-
B. 含有大量Al3+的溶液:Na+、Cl-、HCO3-、SO42-
C. 能使淀粉碘化钾试纸显蓝色的溶液:K+、![]() 、S2-、SO32-
、S2-、SO32-
D. 常温下![]() =1012的溶液:Fe2+、Mg2+、NO3-、Cl-
=1012的溶液:Fe2+、Mg2+、NO3-、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知0.1 mol/L的氨水溶液中存在电离平衡:NH3·H2O![]() NH4++OH-,对于该平衡,下列叙述正确的是
NH4++OH-,对于该平衡,下列叙述正确的是
A. 加入水时,平衡向逆反应方向移动
B. 加入少量NaOH固体,平衡向正反应方向移动
C. 加入少量0.1 mol/LHCl溶液,溶液中c(OH-)减小
D. 加入少量NH4Cl固体,平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知硫酸铜加热分解生成CuO、O2、SO2和SO3(g)。通过测定产生的三种气体的量可确定该反应的方程式。实验用到的仪器如下图所示。

有关操作和结果如下(已知:H++HSO3-=SO2↑+H2O)。
①准确称取一定质量的无水CuSO4固体充分加热到完全分解。
②实验后测得装置F总质量比实验前减少了0.96 g(忽略水蒸气的损失和SO2的溶解)。
③干燥管C在实验后质量增加3.84 g。
④由量筒中水的体积,折算出标准状况下相应气体的体积为224 mL。
试回答下列问题:
(1)装置C的作用是__________________,装置F的作用是______________。
(2)使用上图所给仪器装置(可重复使用),按从左到右的方向连接各仪器,接口顺序为①→⑨⑩→⑥⑤→________→________→________→②(填序号) 。
(3)装置F中发生反应的化学方程式为_______________________________________。
(4)请通过计算,推断出该条件下反应的化学方程式为_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国科学院官方微信于2017年3月发表《灰霾专题》,提出灰霾中细颗粒物的成因,部分分析如下图所示。

(1)根据上图信息可以看出,下列哪种气体污染物不是由机动车行驶造成的_________,
a.SO2 b.NOx c.VOCs d. NH3
(2)机动车大量行驶是污染源之一。汽车发动机废气稀燃控制系统主要工作原理如图所示;写出稀燃过程中NO发生的主要反应的方程式_______。

(3)SO2是气体污染物的主要成分之一。作为一种化学性质活泼的物质,它能发生多种反应,请按照下表提示,从不同角度梳理SO2不同类的化学性质,将化学方程式填在下表中。
SO2性质梳理 | 化学方程式 | |
物质类别 | 酸性氧化物 | ①SO2 +H2O |
②SO2 + CaO = CaSO3 | ||
③_______________________ | ||
S元素 价态 | S为+4价 | ①_______________________ |
② SO2 + 2H2S = 3S + 2H2O | ||
(4)科学家经过研究发现中国霾呈中性,其主要原因如图所示:

请判断A的化学式并说明判断理由:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值。下列说法正确的是( )
A. 5NH4NO3![]() 2HNO3+4N2↑+9H2O反应中,生成28gN2,转移的电子数目为3.75NA
2HNO3+4N2↑+9H2O反应中,生成28gN2,转移的电子数目为3.75NA
B. 室温下,0.2mol·L-1的Na2SO4溶液中含Na+数目为0.4NA
C. 标准状况下,NA个HF分子所占的体积约为22.4L
D. 高温下,0.2molFe与足量水蒸气反应,生成的H2分子数目为0.3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要480 mL 1 mol·L-1 NaOH溶液,根据溶液配制情况回答下列问题:
(1)实验中除了托盘天平(砝码)、药匙、量筒、烧杯、玻璃棒外还需要的其他仪器有______ 、 ___。
(2)下图是某同学在实验室配制该NaOH溶液的过程示意图,其中有错误的是_______(填操作序号)。

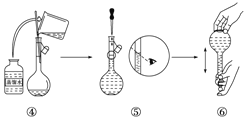
(3)称取NaOH固体时,所需砝码的质量为___________(填写字母)
A.19.2g B.20g C.19.2g ~20g D.大于20g
(4)在溶液的配制过程中,有以下基本实验步骤,其中只需进行一次的操作步骤的是(填写操作步骤的代号)_____________
①称量 ②溶解 ③转移 ④洗涤 ⑤定容 ⑥摇匀
(5)下列操作会导致所配溶液的物质的量浓度偏高的是_________
A.NaOH固体长期暴露在空气中
B.用水溶解NaOH固体后,立即转入容量瓶中定容
C.称量碳酸钠固体时,若将物质和砝码放反
D.定容后发现液面高于刻线,可用胶头滴管将多余的水吸出
E.定容时俯视刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Y形管是一种特殊的仪器,与其他仪器组合可以进行某些实验探究。利用下图装置可以探究SO2与BaCl2反应生成BaSO3沉淀的条件。下列判断正确的是

A. 玻璃管的作用是连通大气,使空气中的氧气进入广口瓶,参与反应
B. c、d两根导管都必须插入BaCl2溶液中,保证气体与Ba2+充分接触
C. Y形管乙中产生的为氧化性气体,将BaSO3氧化为BaSO4沉淀
D. e、f两管中的试剂可以分别是浓氨水和NaOH固体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com