
【题目】实验室需要480 mL 1 mol·L-1 NaOH溶液,根据溶液配制情况回答下列问题:
(1)实验中除了托盘天平(砝码)、药匙、量筒、烧杯、玻璃棒外还需要的其他仪器有______ 、 ___。
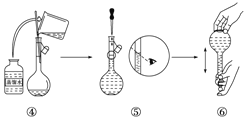
(2)下图是某同学在实验室配制该NaOH溶液的过程示意图,其中有错误的是_______(填操作序号)。

(3)称取NaOH固体时,所需砝码的质量为___________(填写字母)
A.19.2g B.20g C.19.2g ~20g D.大于20g
(4)在溶液的配制过程中,有以下基本实验步骤,其中只需进行一次的操作步骤的是(填写操作步骤的代号)_____________
①称量 ②溶解 ③转移 ④洗涤 ⑤定容 ⑥摇匀
(5)下列操作会导致所配溶液的物质的量浓度偏高的是_________
A.NaOH固体长期暴露在空气中
B.用水溶解NaOH固体后,立即转入容量瓶中定容
C.称量碳酸钠固体时,若将物质和砝码放反
D.定容后发现液面高于刻线,可用胶头滴管将多余的水吸出
E.定容时俯视刻度线
【答案】胶头滴管、500mL容量瓶 ①③⑤ D ②⑤ BE
【解析】
(1)根据配制步骤是计算、称量、溶解、移液、洗涤、定容、摇匀、装瓶来分析需要的仪器;
(2)依据配置一定物质的量浓度溶液的正确操作步骤和仪器的正确使用方法解答;
(3)根据n=cV、m=nM计算出500mL1.0mol/L的NaOH溶液中含有溶质氢氧化钠的质量,然后根据氢氧化钠的称量要放到小烧杯里称量来分析;
(4)根据实验操作的方法进行判断;
(5)根据实验操作对c=![]() 的影响进行误差分析。
的影响进行误差分析。
(1)操作步骤有计算、称量、溶解、移液、洗涤、定容、摇匀等操作,一般用托盘天平称量,用药匙取用药品,在烧杯中溶解(可用量筒量取水加入烧杯),并用玻璃棒搅拌,加速溶解。冷却后转移到500mL容量瓶中,并用玻璃棒引流,洗涤烧杯、玻璃棒23次,并将洗涤液移入容量瓶中,加水至液面距离刻度线12cm时,改用胶头滴管滴加,最后定容颠倒摇匀。所以所需仪器有托盘天平、烧杯、玻璃棒、500mL容量瓶、胶头滴管。根据提供的仪器可知,还需仪器有500ml容量瓶、胶头滴管;
(2)①量筒为量取仪器,不能用来溶解物质,故①错误;
②用玻璃杯搅拌加速固体的溶解,故②正确;
③玻璃棒引流操作时,玻璃棒下端应靠在容量瓶刻度线下方,故③错误;
④加水至刻度线的下方,操作正确,故④正确;
⑤定容时,眼睛应平视刻度线,故⑤错误;
⑥加盖摇匀,使溶液混合均匀,操作正确,故⑥正确;故答案为:①③⑤;
(3)由于无450mL的容量瓶,故选用500mL的容量瓶,配制出500mL的1.0mol/L的溶液,500mL1.0mol/L的氢氧化钠溶液中含有溶质的质量为:m=1.0mol/L×0.5L×40g/mol=20g,需要称量的氢氧化钠的质量为20.0g,而称量氢氧化钠固体时,要放到小烧杯里称量,故选用的砝码的质量大于20.0g,故答案为:D;
(4)①称量时先称空烧杯的质量再称烧杯和药品的质量,故①错误;
②固体在烧杯中溶解,冷却后转移到500mL容量瓶中,只有1次,故②正确;
③转移时除了将溶液转移到容量瓶中还要将洗涤液转移到容量瓶中,故②错误;
④洗涤时要洗涤烧杯及玻璃棒23次,故④错误;
⑤定容时,当加水至液面距离刻度线12cm时,改用胶头滴管滴加,使溶液的凹液面的最低点与刻线相平,只有1次,故正确;
⑥摇匀要在移液后摇匀一次,在定容后再摇匀一次,故⑤错误;故选:②⑤;
(5)A.NaOH固体长期暴露在空气中,导致部分氢氧化钠变质,配制的溶液中溶质的物质的量偏小,配制的浓度偏低,故A错误;
B.用水溶解NaOH固体后,立即转入容量瓶中定容,热的溶液体积偏大,冷却后体积变小,则配制的溶液体积偏小,配制的溶液浓度偏高,故B正确;
C.称量碳酸钠固体时,若将物质和砝码放反,称量出的氢氧化钠的质量偏小,配制的溶液浓度偏低,故C错误;
D.定容后发现液面高于刻线,若用胶头滴管将多余的水吸出,配制的溶液中溶质的物质的量偏小,配制的溶液浓度偏低,故D错误;
E.定容时俯视刻度线,导致加入的蒸馏水体积偏小,配制的溶液体积偏小,则配制的溶液浓度偏高,故E正确。


科目:高中化学 来源: 题型:
【题目】下列物质与水反应生成强碱的是( )
A. NH3 B. Na2O C. CO2 D. NO2
【答案】B
【解析】
A. NH3溶于水生成一水合氨,属于弱碱,A错误;B. Na2O溶于水生成氢氧化钠,是强碱,B正确;C. CO2溶于水生成碳酸,属于弱酸,C错误;D. NO2溶于水生成硝酸和NO,硝酸是强酸,D错误,答案选B。
【题型】单选题
【结束】
19
【题目】利用下列装置可以完成的实验组合是
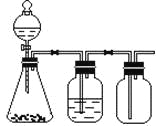
选项 | 制气装置 | 洗气瓶中试剂 | 瓶中气体 |
A | 氯酸钾 MnO2 | 浓硫酸 | O2 |
B | 石灰石 稀盐酸 | NaHCO3溶液 | CO2 |
C | Zn 稀硫酸 | 浓硫酸 | H2 |
D | MnO2 浓盐酸 | 浓硫酸 | Cl2 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 用盐酸标准溶液测定NaOH溶液浓度滴定实验中,滴定前无气泡而滴定后有气泡,会使测定值偏高
B. 将地下钢管与直流电源的正极相连,用来保护钢管
C. 已知在101KPa下,1gH2燃烧生成水蒸气放出121kJ热量,其热化学方程式为:2H2(g)+O2(g)=2H2O(g)△H=-484kJ·mol-1
D. 25℃,101kPa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3kJ·mol-1,表示稀H2SO4与KOH溶液反应的中和热的热化学方程式为:H2SO4(aq)+2KOH(aq)=K2SO4(aq)+2H2O(l)△H=-114.6kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氧化二镍(Ni2O3)是一种重要的电子元件材料和蓄电池材料。工业上利用含镍废料(镍、铁、钙、镁合金为主)制取草酸镍(NiC2O4·2H2O),再高温煅烧草酸镍制取三氧化二镍。已知草酸的钙、镁、镍盐均难溶于水。工艺流程图如图所示:
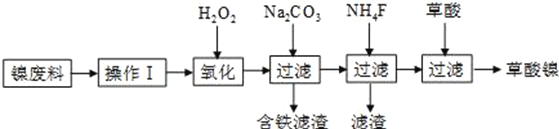
请回答下列问题:
(1)操作Ⅰ为__________________________。
(2)①加入H2O2发生的主要反应的离子方程式为_____________________________;
②加入碳酸钠溶液目的是调溶液的pH值在4.0~5.0,用化学用语回答加入碳酸钠的目的_________________________________________________________________。
(3)草酸镍(NiC2O4·2H2O)在热空气中干燥脱水后在高温下煅烧,可制得Ni2O3,同时获得混合气体,NiC2O4受热分解的化学方程式为___________________________________。
(4)加入草酸后如何证明沉淀完全______________________________________________;
过滤NiC2O4沉淀时如何洗涤沉淀_________________________________________________。
(5)以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2,则该电池负极的电极反应式为__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图曲线表示物质A生成物质P的化学反应在无催化条件和有酶催化条件下的能量变化过程。据图判断不正确的是
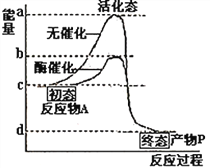
A. bc段表示在有酶催化条件下,使物质A生成物质P反应发生需要的活化能
B. ad段表示在无催化剂催化的条件下,使物质A生成物质P反应发生需要的活化能
C. 若物质A与物质P之间转化的反应为可逆反应,酶可同样地降低正、逆反应的活化能
D. 若将酶催化改为无机催化剂催化该反应,则b在纵轴上将向上移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组利用下图所列装置进行“铁与水蒸气反应”的实验,并利用产物进一步制取FeCl36H2O晶体(图中夹持及尾气处理装置均已略去)。请回答下列问题:
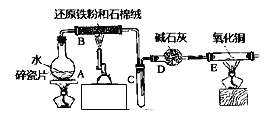
(1)装置B中发生反应的化学方程式是______________________________.
(2)E中出现的现象是______________________.
(3)该小组把B中反应后的产物加入到足量的盐酸中,用该溶液制取FeCl36H2O晶体.
①欲检验溶液中含有Fe3+,选用的试剂为________________,现象是_______________.
②该实验小组同学用上述试剂没有检测到Fe3+,用离子方程式解释滤液中不存在Fe3+可能的原因:_______________________.
③将此滤液中FeCl2完全氧化为FeCl3最好选择下列物质中的_______.
A.酸性KMnO4溶液 B.Cl2 C.Na2O2 D.FeCl3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于1L H2SO4和HNO3的混合溶液,若H2SO4和HNO3物质的量浓度存在如下关系:c(H2SO4)+c(HNO3)=1.2mol/L,则理论上最多能溶解铜的物质的量为
A. 0.40mol B. 0.45mol C. 0.72mol D. 0.80mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组用如图装置进行SO2与FeCl3溶液反应的相关实验(夹持装置已略去)。

(1)通入足量SO2时C中观察到的现象为_____________________________。
(2)根据以上现象,该小组同学认为SO2与FeCl3溶液发生氧化还原反应。
①写出SO2与FeCl3溶液反应的离子方程式______________________________;
②请设计实验方案检验有Fe2+生成_________________________。
③该小组同学向C试管反应后的溶液中加入硝酸酸化的BaCl2溶液,若出现白色沉淀,即可证明反应生成了SO42-。该做法_______(填“合理”或“不合理”),理由是____________
(3)为了验证SO2具有还原性,实验中可以代替FeCl3的试剂有________(填序号)。
A.浓硫酸 B.酸性KMnO4溶液 C.碘水 D.NaCl溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是人类较早使用的金属之一。运用所学知识,回答下列问题。
(1)鉴别Fe(OH)3胶体和FeCl3溶液最好的方法是_______(写出具体实验操作,结论)。
(2)电子工业用FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板,请写出FeCl3溶液与铜反应的离子方程式:__________________________________。
(3)某研究性学习小组为测定FeCl3腐蚀铜后所得溶液的组成,进行了如下实验:
①取少量待测溶液,滴入KSCN溶液呈红色,则待测液中含有的金属阳离子是_____;
②溶液组成的测定:取50.0mL待测溶液,加入足量的AgNO3溶液,得到21.525g白色沉淀。则溶液中c(Cl-)=______mol/L。
③验证该溶液中是否含有Fe2+,正确的实验方法是_____________。
A.观察溶液是否呈浅绿色
B.取适量溶液,滴入酸性高锰酸钾溶液,若褪色,证明含有Fe2+
C.取适量溶液先滴入氯水再滴入KSCN溶液,若显血红色,证明原溶液中含有Fe2+
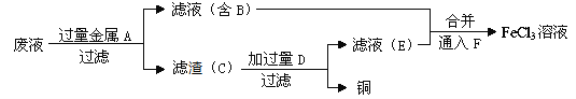
(4)工程师欲从制造印刷电路板的废水中回收铜,并获得FeCl3溶液,设计如下方案:
①滤渣C的化学式为_________________。
②加过量D发生反应的离子方程为_____________________________________。
③通入F发生反应的离子方程式为 ____________________________________ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com