
【题目】铁是人类较早使用的金属之一。运用所学知识,回答下列问题。
(1)鉴别Fe(OH)3胶体和FeCl3溶液最好的方法是_______(写出具体实验操作,结论)。
(2)电子工业用FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板,请写出FeCl3溶液与铜反应的离子方程式:__________________________________。
(3)某研究性学习小组为测定FeCl3腐蚀铜后所得溶液的组成,进行了如下实验:
①取少量待测溶液,滴入KSCN溶液呈红色,则待测液中含有的金属阳离子是_____;
②溶液组成的测定:取50.0mL待测溶液,加入足量的AgNO3溶液,得到21.525g白色沉淀。则溶液中c(Cl-)=______mol/L。
③验证该溶液中是否含有Fe2+,正确的实验方法是_____________。
A.观察溶液是否呈浅绿色
B.取适量溶液,滴入酸性高锰酸钾溶液,若褪色,证明含有Fe2+
C.取适量溶液先滴入氯水再滴入KSCN溶液,若显血红色,证明原溶液中含有Fe2+
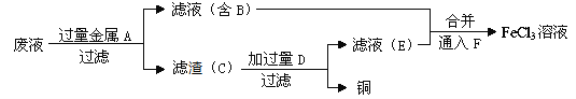
(4)工程师欲从制造印刷电路板的废水中回收铜,并获得FeCl3溶液,设计如下方案:
①滤渣C的化学式为_________________。
②加过量D发生反应的离子方程为_____________________________________。
③通入F发生反应的离子方程式为 ____________________________________ 。
【答案】用一束光照射,出现光亮通路的是Fe(OH)3胶体,不出现光亮通路的是FeCl3溶液 Cu+2Fe3+ =Cu2++2Fe2+ Fe3+ 3 B Fe、Cu Fe+2H+=Fe2++H2 Cl2+2Fe2+ =2Cl-+2Fe3+
【解析】
(1)鉴别溶液和胶体的最简单的方法是丁达尔现象,胶体具有丁达尔现象,而溶液不具有;
(2)利用Fe3+的强氧化性,结合电子守恒、原子守恒书写;
(3)①根据FeCl3溶液与铜反应:2Fe3++Cu═2Fe2++Cu2+;滴入KSCN溶液呈红色分析;
②先计算氯化银的物质的量是0.15mol,利用Cl元素守恒,确定氯离子物质的量为0.15mol,
③检验的Fe2+方法可根据其还原性及反应产生的铁离子遇KSCN溶液变为红色;
(4)根据制取的目标产物是氯化铁,金可知A是铁;滤液B是氯化亚铁溶液;加入的铁过量,滤渣C是铁和铜;制取的是氯化铁,溶解铁,D加入应该是盐酸,E为氯化亚铁,氯化亚铁与氯气反应生成氯化铁,所以F为氯气,据此回答①②③。
(1)因FeCl3溶液是溶液,无丁达尔现象,而Fe(OH)3胶体是胶体,有丁达尔现象,所以鉴别FeCl3溶液和Fe(OH)3胶体中最简单有效的是观察是否产生了丁达尔现象(效应);
(2)铜与氯化铁反应生成氯化铜、氯化亚铁,反应的离子方程式为:Cu+2Fe3+=Cu2++2Fe2+;
(3)①测定FeCl3腐蚀铜后所得溶液的组成,由于滴入KSCN溶液呈红色,证明溶液中一定有Fe3+,溶液中还含有腐蚀Cu后生成的Cu2+、Fe2+,所以含有的金属离子是Fe3+、Cu2+、Fe2+;
②取50.0mL待测溶液,加入足量的AgNO3溶液,得21.525g白色沉淀,n(AgCl)=![]() mol,根据Cl元素守恒,可知n(Cl-)= 0.15mol,则溶液中c(Cl-)=
mol,根据Cl元素守恒,可知n(Cl-)= 0.15mol,则溶液中c(Cl-)=![]() ;
;
③A.观察溶液是否呈浅绿色,当溶液浓度较小时,溶液几乎无色,所以不能证明,A错误;
B.Fe2+具有还原性,能被酸性KMnO4溶液氧化,所以向试管中加入试液,滴入酸性高锰酸钾溶液,若褪色,证明含有Fe2+;B正确;
C.试管中加入试液,滴入氯水,再滴入KSCN溶液,若显血红色,只能证明反应后溶液中含有Fe3+,不能证明原溶液是否含有Fe2+;应该先加入硫氰化钾溶液,若溶液不变色,证明无Fe3+,再加入氯水,若溶液显示红色,证明此时溶液中含有Fe3+,是Cl2氧化Fe2+而产生的Fe3+,说明原溶液含有Fe2+,C错误;
故合理选项是B;
(4)目标产物是氯化铁溶液,则金属A是铁;滤液B是氯化亚铁溶液;由于加入的铁过量,所以滤渣C是铁和铜;制取的物质是氯化铁,则溶解铁加入D物质应该是盐酸,E为氯化亚铁,氯化亚铁与氯气反应生成氯化铁,所以F为氯气。
①滤渣C的化学式为Fe、Cu;
②加过量盐酸发生反应的离子方程式为Fe+2H+=Fe2++H2↑;
③是将Fe2+氧化成Fe3+,反应方程式是:2FeCl2+Cl2=2FeCl3。


科目:高中化学 来源: 题型:
【题目】实验室需要480 mL 1 mol·L-1 NaOH溶液,根据溶液配制情况回答下列问题:
(1)实验中除了托盘天平(砝码)、药匙、量筒、烧杯、玻璃棒外还需要的其他仪器有______ 、 ___。
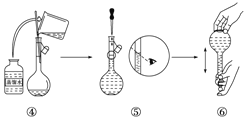
(2)下图是某同学在实验室配制该NaOH溶液的过程示意图,其中有错误的是_______(填操作序号)。

(3)称取NaOH固体时,所需砝码的质量为___________(填写字母)
A.19.2g B.20g C.19.2g ~20g D.大于20g
(4)在溶液的配制过程中,有以下基本实验步骤,其中只需进行一次的操作步骤的是(填写操作步骤的代号)_____________
①称量 ②溶解 ③转移 ④洗涤 ⑤定容 ⑥摇匀
(5)下列操作会导致所配溶液的物质的量浓度偏高的是_________
A.NaOH固体长期暴露在空气中
B.用水溶解NaOH固体后,立即转入容量瓶中定容
C.称量碳酸钠固体时,若将物质和砝码放反
D.定容后发现液面高于刻线,可用胶头滴管将多余的水吸出
E.定容时俯视刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Y形管是一种特殊的仪器,与其他仪器组合可以进行某些实验探究。利用下图装置可以探究SO2与BaCl2反应生成BaSO3沉淀的条件。下列判断正确的是

A. 玻璃管的作用是连通大气,使空气中的氧气进入广口瓶,参与反应
B. c、d两根导管都必须插入BaCl2溶液中,保证气体与Ba2+充分接触
C. Y形管乙中产生的为氧化性气体,将BaSO3氧化为BaSO4沉淀
D. e、f两管中的试剂可以分别是浓氨水和NaOH固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示为密闭容器中反应C+H2O(g)![]() CO+H2 ΔH>0达到平衡后,由于条件改变而引起正、逆反应速率的变化以及平衡移动的情况。下列说法错误的是
CO+H2 ΔH>0达到平衡后,由于条件改变而引起正、逆反应速率的变化以及平衡移动的情况。下列说法错误的是
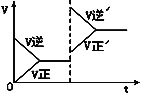
A. 起始反应物为CO和H2
B. 改变条件后平衡逆向移动
C. 改变的条件是增大压强
D. 新平衡时CO的浓度比原平衡小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属及其化合物的种类很多,我们可以按照“金属单质、金属氧化物、金属氢氧化物、盐”的类别进行研究。以下是元素周期表中前18号某种金属元素对应的单质及其化合物之间的转化关系(“→”所指的转化都是一步完成)。
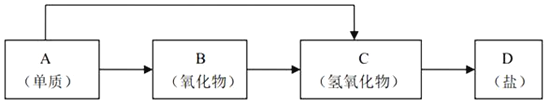
(1)若B为呼吸面具中的供氧剂,其供氧时每生成1molO2,反应过程中转移的电子数为___________________,A与水反应的离子方程式为:_____________________。
(2)200℃时,11.6g CO2和H2O的混合物气体与足量的B反应,反应后固体增加了3.6g,则原混合物的平均相对分子质量为______________。
(3)写出一种“C→D”转化的离子方程式:___________________________________。
(4)某同学将一小块A单质露置于空气中,观察到下列现象:
银白色![]() 变灰暗
变灰暗![]() 变白色
变白色![]() 出现液滴
出现液滴![]() 白色固体
白色固体
则下列说法正确的是_____________________。
A.①发生了氧化还原反应
B.①变灰暗色是因为生成了过氧化钠
C.③是碳酸钠吸收空气中的水蒸气形成了溶液
D.④只发生物理变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W、Q是原子序数依次增大的五种短周期主族元素。其中只有Z是金属元素,W的单质是黄色固体,X、Y、W在周期表中的相对位置关系如图所示。下列说法正确的是( )
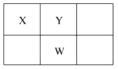
A. Z的最高价氧化物对应的水化物不可能显弱碱性
B. Y的简单阴离子比W的简单阴离子的还原性弱
C. X、W、Q的氢化物均可在Y的单质中燃烧
D. Q的氢化物的水溶液能与W的盐反应得到W的氢化物,说明非金属性Q>W
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据所学知识填写下列空白。
(1)已知拆开1mol H-H键,1mol N-H键,1mol N≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成1mol NH3的反应热ΔH =__________________。
(2)氢气的燃烧热为286kJ/mol。写出表示氢气燃烧热的热化学方程式____________________________________________。
(3)某温度下纯水中的c(H+) = 1×10-6.5mol/L。若温度不变,滴入稀硫酸使c(H+)= 5×10-5mol/L,则由水电离出的c(H+) =__________mol/L。
(4)已知在第(3)问条件下,盐酸的pH=a,氢氧化钡的pH=b。若酸碱按体积比1:10混合后溶液显中性,则a+b=_________。
(5)某二元酸(化学式用H2B表示)在水中的电离方程式是H2B=H++HB-, HB- ![]() H++B2-。
H++B2-。
已知0.1 mol/L NaHB溶液的pH=2,则0.1 mol/L H2B溶液中c(H+)小于0.11 mol/L的原因是____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼镁泥是硼镁矿生产硼砂晶体(Na2B4O7·10H2O)时的废渣,其主要成分是MgO,还含有Na2B4O7、CaO、Fe2O3、FeO、MnO、SiO2等杂质。以硼镁泥为原料制取七水硫酸镁的工艺流程如下:

回答下列问题:
(l)Na2B4O7·10H2O中B的化合价为__________。
(2)Na2B4O7易溶于水,也易发生水解:B4O72-+7H2O![]() 4H3BO3(硼酸)+2OH-(硼酸在常温下溶解度较小)。写出加入硫酸时Na2B4O7发生反应的化学方程式:______________。
4H3BO3(硼酸)+2OH-(硼酸在常温下溶解度较小)。写出加入硫酸时Na2B4O7发生反应的化学方程式:______________。
(3)滤渣B中含有不溶于稀盐酸但能溶于热浓盐酸的黑色固体,写出生成黑色固体的离子方程式____________。
(4)加入MgO的目的是___________________。
(5)已知MgSO4、CaSO4的溶解度如下表:
温度(℃) 溶解度(g) | 40 | 50 | 60 | 70 |
MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
“操作A”是将MgSO4和CaSO4混合溶液中的CaSO4除去,根据上表数据,简要说明“操作A”步骤为____________________。
(6)硼砂也能在工业上制取NaBH4,NaBH4被称为有机化学中的“万能还原剂”。
①写出NaBH4的电子式:___________。
②“有效氢含量”可用来衡量含氢还原剂的还原能力,其定义是:每克含氢还原剂的还原能力相当于多少克H2的还原能力。NaBH4的有效氢含量为_________(保留两位小数)。
③在碱性条件下,在阴极上电解NaBO2也可制得硼氢化钠,写出阴极室的电极反应式:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素R、X、Y、Z 在周期表中的相对位置如图所示。已知: Y的最高价氧化物对应的水化物既能与强碱反应,又能与强酸反应。下列说法不正确的是
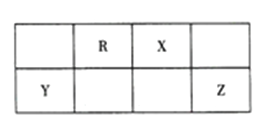
A. 简单气态氢化物的热稳定性: R<X
B. Y、Z的简单离子在同一溶液中能大量共存
C. 工业上,采用电解法冶炼单质Y
D. RZ2是含极性键的共价化合物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com