
����Ŀ��������ѧ֪ʶ��д���пհס�
��1����֪��1mol H��H����1mol N��H����1mol N��N���ֱ���Ҫ��������436kJ��391kJ��946kJ����N2��H2��Ӧ����1mol NH3�ķ�Ӧ�Ȧ�H =__________________��
��2��������ȼ����Ϊ286kJ/mol��д����ʾ����ȼ���ȵ��Ȼ�ѧ����ʽ____________________________________________��
��3��ij�¶��´�ˮ�е�c(H+) = 1��10��6.5mol/L�����¶Ȳ��䣬����ϡ����ʹc(H+)= 5��10��5mol/L������ˮ�������c(H+) =__________mol/L��
��4����֪�ڵڣ�3���������£������pH=a������������pH=b�����������1:10��Ϻ���Һ�����ԣ���a+b=_________��
��5��ij��Ԫ�ᣨ��ѧʽ��H2B��ʾ����ˮ�еĵ��뷽��ʽ��H2B=H��+HB��, HB�� ![]() H��+B2����
H��+B2����
��֪0.1 mol/L NaHB��Һ��pH=2����0.1 mol/L H2B��Һ��c(H+)С��0.11 mol/L��ԭ����____________________________________��
���𰸡� ��H����46kJ/mol H2(g)+1/2O2(g)=H2O ��H����286kJ/mol 2��10��9 12 H2B��һ�����������H��������HB���ĵ���
��������(1)��Ӧ�ȵ��ʱ���H=��Ӧ���ܼ���-�������ܼ�����N2��H2��Ӧ����NH3�ķ�Ӧ����ʽΪN2 + 3H2 ![]() 2NH3������H =946kJ/mol+436kJ/mol��3-391kJ/mol��6=��46kJ/mol���ʴ�Ϊ����46kJ/mol��
2NH3������H =946kJ/mol+436kJ/mol��3-391kJ/mol��6=��46kJ/mol���ʴ�Ϊ����46kJ/mol��
(2)������ȼ����Ϊ286kJ/mol��������ȼ���ȵ��Ȼ�ѧ����ʽΪH2(g)+1/2O2(g)=H2O ��H����286kJ/mol���ʴ�Ϊ��H2(g)+1/2O2(g)=H2O ��H����286kJ/mol��
(3)ij�¶��´�ˮ�е�c(H+) = 1��10��6.5mol/L����Kw=1��10��6.5mol/L��1��10��6.5mol/L=1��10��13�����¶Ȳ��䣬����ϡ����ʹc(H+)= 5��10��5mol/L����c(OH-)=![]() mol/L =2��10��9 mol/L�������ˮ�������c(H+) =2��10��9mol/L���ʴ�Ϊ��2��10��9��
mol/L =2��10��9 mol/L�������ˮ�������c(H+) =2��10��9mol/L���ʴ�Ϊ��2��10��9��
(4)��֪�ڵ�(3)�������£������pH=a��c(H+) =1��10��amol/L������������pH=b��c(H+) =1��10��bmol/L����c(OH-)=1��10��(13-b)mol/L�����������1:10��Ϻ���Һ�����ԣ�˵����������������ǡ����ȫ��Ӧ�����1��10��amol/L��V=1��10��(13-b)mol/L��10V�����a+b=12���ʴ�Ϊ��12��
(5)0.1 mol/L NaHB��Һ��pH=2����c(H+) =0.01mol/L����0.1 mol/L H2B��Һ�д���H2B=H��+HB��, HB�� ![]() H��+B2����H2B��һ�����������H��������HB���ĵ��룬����0.1 mol/L H2B��Һ��c(H+) ��0.11mol/L���ʴ�Ϊ��H2B��һ�����������H��������HB���ĵ�����
H��+B2����H2B��һ�����������H��������HB���ĵ��룬����0.1 mol/L H2B��Һ��c(H+) ��0.11mol/L���ʴ�Ϊ��H2B��һ�����������H��������HB���ĵ�����



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������1L H2SO4��HNO3�Ļ����Һ����H2SO4��HNO3���ʵ���Ũ�ȴ������¹�ϵ��c(H2SO4)+c(HNO3)=1.2mol/L����������������ܽ�ͭ�����ʵ���Ϊ
A. 0.40mol B. 0.45mol C. 0.72mol D. 0.80mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ӧ4A(s)+3B(g)=2C(g)+D(g)����2min B��Ũ�ȼ���0.6 mol/L���йط�Ӧ���ʵ�˵����ȷ����
A. ��A��ʾ�ķ�Ӧ������0.4 mol/(L��min)
B. �ֱ���A��B��C��D��ʾ��Ӧ�����ʣ����ֵ��4:3:2:1
C. 2 min�ڵķ�Ӧ���ʣ���B��ʾ��0.3 mol/(L��min)
D. ����2 min����B��C��ʾ�ķ�Ӧ���ʵ�ֵ������С��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������ʹ�õĽ���֮һ��������ѧ֪ʶ���ش��������⡣
(1)����Fe(OH)3�����FeCl3��Һ��õķ�����_______(д������ʵ�����������)��
(2)���ӹ�ҵ��FeCl3��Һ��ʴ���ھ�Ե���ϵ�ͭ������ӡˢ��·�壬��д��FeCl3��Һ��ͭ��Ӧ�����ӷ���ʽ��__________________________________��
(3)ij�о���ѧϰС��Ϊ�ⶨFeCl3��ʴͭ��������Һ����ɣ�����������ʵ�飺
��ȡ����������Һ������KSCN��Һ�ʺ�ɫ�������Һ�к��еĽ�����������_____��
����Һ��ɵIJⶨ��ȡ50.0mL������Һ������������AgNO3��Һ���õ�21.525g��ɫ����������Һ��c(Cl-)=______mol/L��
����֤����Һ���Ƿ���Fe2+����ȷ��ʵ�鷽����_____________��
A���۲���Һ�Ƿ��dz��ɫ
B��ȡ������Һ���������Ը��������Һ������ɫ��֤������Fe2+
C��ȡ������Һ�ȵ�����ˮ�ٵ���KSCN��Һ������Ѫ��ɫ��֤��ԭ��Һ�к���Fe2+
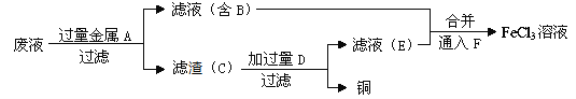
(4)����ʦ��������ӡˢ��·��ķ�ˮ�л���ͭ�������FeCl3��Һ��������·�����
������C�Ļ�ѧʽΪ_________________��
���ӹ���D������Ӧ�����ӷ���Ϊ_____________________________________��
��ͨ��F������Ӧ�����ӷ���ʽΪ ____________________________________ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£�Ũ�Ⱦ�Ϊ0.1mol��L-1�������ΪVo��HA��HB��Һ���ֱ��ˮϡ����V��pH��![]() �ı仯��ͼ��ʾ������˵����ȷ����
�ı仯��ͼ��ʾ������˵����ȷ����
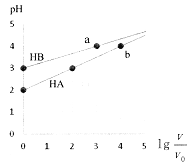
A. HAΪǿ�ᣬHBΪ���� B. ˮ�ĵ���̶�a�����b��
C. ��pH=2ʱ��HA��Һ��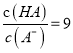 D. ��Ũ�ȵ������HB��Na0H��Һ��ַ�Ӧ������Ũ�ȹ�ϵ��СΪ��c(B-)> c(Na+)>c(H+)>c(OH-)
D. ��Ũ�ȵ������HB��Na0H��Һ��ַ�Ӧ������Ũ�ȹ�ϵ��СΪ��c(B-)> c(Na+)>c(H+)>c(OH-)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±��������dz�����HClO��H2CO3�ĵ��볣�����ش��й����⡣

��1����������ȷ��ʾˮ������ӷ���ʽ����______________��
A��HCO3�� + H2O![]() H2CO3+OH�� B��HClO + H2O
H2CO3+OH�� B��HClO + H2O![]() ClO��+ H3O+
ClO��+ H3O+
C��HCO3�� + H2O![]() CO32��-+H3O+ D��CO32��+2H2O
CO32��-+H3O+ D��CO32��+2H2O ![]() H2CO3+2OH��
H2CO3+2OH��
��2��Ũ����ͬ�Ģ�Na2CO3����NaHCO3����NaClO������Һ��pH��С�������е�˳��Ϊ(�ñ����д)________________________��
��3��д��NaClO��Һ��ͨ������CO2��������ӷ���ʽ________________________��
��4����������ˮ�м�������̼�����Ʒ�ĩ����ˮ��Ư��������ǿ�������йػ�ѧ֪ʶ����ԭ��_____________________________________________��
��5���ڵ�Ũ�ȵ�NaClO��NaHCO3�����Һ�У�������Ũ�ȵĴ�С��ϵ��__________��
��6����pH=8��NaClO��HClO���Һ�У�c(ClO��)/c(HClO)=____________________��
��7����֪HClO��aq����NaOH��aq����Ӧ�Ħ�H =��a kJ/mol��HCl��aq����Һ��NaOH��aq����Ӧ�Ħ�H =��b kJ/mol����HClO��ˮ��Һ�е���Ħ�H����____________��
��8��pH=12��NaClO��Һ�У�c(HClO)=___________mol/L������ȷ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ���������Ӧ��ѧ����ʽ����ȷ���ǣ� ��
A. ��Ͷ��ˮ�У�����ˮ���۳�С����ˮ������ƶ����õ�����Һ�Լ��ԣ�2 Na + 2 H2O ![]() 2 NaOH + H2��
2 NaOH + H2��
B. �����������а�����ȼ�գ���������ɫ���棬ƿ�ڳ��ְ�����H2 + Cl2 ![]() 2HCl
2HCl
C. FeSO4��Һ�м���NaOH��Һʱ�����ɵİ�ɫ��״����Ѹ�ٱ�Ϊ����ɫ������ɺ��ɫ�� 2Fe(OH)2 + O2 + H2O ![]() 2 Fe(OH)3
2 Fe(OH)3
D. ��Na2SiO3��Һ����μ���ϡ���ᣬ�ӱ����й��ὺ�������Na2SiO3 + 2HCl ![]() H2SiO3+ 2NaCl
H2SiO3+ 2NaCl
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1���ڱ�״���¢�6.72L CH4 ��3.01��1023��HCl���Ӣ� 13.6g H2S ��0.2mol NH3, ���ж�����������Ĺ�ϵ�Ӵ�С������ȷ����_____
a������������������� b���ܶȢ�������������
c�������������������� d����ԭ�Ӹ�����������������
��2���ڱ�״���£�CO��CO2�Ļ�����干39.2 L������Ϊ61 g��������CO2Ϊ________mol, COռ�������______(����һλС��)����������Ħ������Ϊ_______(����һλС��)��
��3��ij��������и��������������Ϊ��O232%��N228%��CO222%��CH416%��H22%����˻�������ƽ��Ħ������Ϊ______(������λС��)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������CaSO4Ϊ���������Ȼ��ȼ����һ��������ɫ��ȼ�շ�ʽ,CaSO4��Ϊ������������Ч����,�ܹ���Ч���ܺĵ�ʵ��CO2�ķ���Ͳ�����ԭ������ͼ��ʾ:
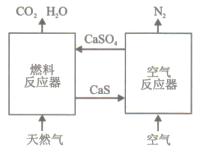
��1����֪��ȼ�Ϸ�Ӧ���з������·�Ӧ:
i.4CaSO4(s)+CH4(g)=4CaO(s)+CO2(g)+4SO2(g)+2H2O(g) ��H1=akJ/mol
ii.CaSO4(s)+CH4(g)=CaS(s)+CO2(g)+2H2O(g) ��H2=bkJ/mol
��. CaS(s)+3CaSO4(s)= 4CaO(s)+4SO2(g) ��H3=ckJ/mol
��ȼ�Ϸ�Ӧ��������ӦΪ_________(����i����ii����������)��
�ڷ�Ӧi��ii��ƽ�ⳣ��Kp���¶ȵĹ�ϵ��ͼ1����a_______0(���� >���� =������<�� );720��ʱ��Ӧ����ƽ�ⳣ��Kp=________��
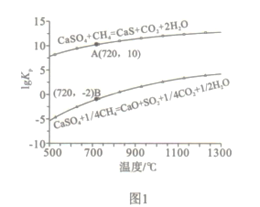
�����д�ʩ����߷�Ӧii�м���ƽ��ת���ʵ���_______��
A.����CaSO4�����Ͷ���� B.��ˮ��������
C.���� D.�����������
��2����ͼ2��ʾ,��ȼ�Ϸ�Ӧ������¶ȷ�ΧΪ850�� -900��֮�䣬�ӻ�ѧ��Ӧԭ���ĽǶ�˵��ԭ��:_______��
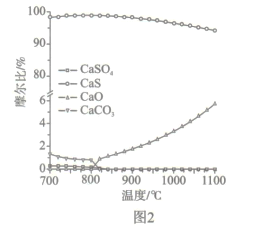
��3��������Ӧ���з����ķ�ӦΪ
CaS(s) +2O2(g)=CaSO4(s) ��H4=dkJ/mol
�ٸ����Ȼ�ѧԭ���Ʋ�÷�ӦΪ__________��Ӧ��
������Ȼ��ȼ�չ�����,��ѭ�����õ�����Ϊ________��
��4����ԭ���ܷ�Ӧ���Ȼ�ѧ����ʽΪ____________
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com