
【题目】反应4A(s)+3B(g)=2C(g)+D(g),经2min B的浓度减少0.6 mol/L。有关反应速率的说法正确的是
A. 用A表示的反应速率是0.4 mol/(L·min)
B. 分别用A、B、C、D表示反应的速率,其比值是4:3:2:1
C. 2 min内的反应速率,用B表示是0.3 mol/(L·min)
D. 在这2 min内用B和C表示的反应速率的值都是逐渐减小的
 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值。下列说法正确的是( )
A. 5NH4NO3![]() 2HNO3+4N2↑+9H2O反应中,生成28gN2,转移的电子数目为3.75NA
2HNO3+4N2↑+9H2O反应中,生成28gN2,转移的电子数目为3.75NA
B. 室温下,0.2mol·L-1的Na2SO4溶液中含Na+数目为0.4NA
C. 标准状况下,NA个HF分子所占的体积约为22.4L
D. 高温下,0.2molFe与足量水蒸气反应,生成的H2分子数目为0.3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Y形管是一种特殊的仪器,与其他仪器组合可以进行某些实验探究。利用下图装置可以探究SO2与BaCl2反应生成BaSO3沉淀的条件。下列判断正确的是

A. 玻璃管的作用是连通大气,使空气中的氧气进入广口瓶,参与反应
B. c、d两根导管都必须插入BaCl2溶液中,保证气体与Ba2+充分接触
C. Y形管乙中产生的为氧化性气体,将BaSO3氧化为BaSO4沉淀
D. e、f两管中的试剂可以分别是浓氨水和NaOH固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂-空气电池原理模型如图所示,下列说法不正确的是

A. 电池正极可以吸附空气中氧气作为氧化剂
B. 正极反应为2Li+ + O2 + 2e- ![]() Li2O2
Li2O2
C. 电解质能传递锂离子和电子,不可以用水溶液
D. 负极反应Li - e-=Li+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示为密闭容器中反应C+H2O(g)![]() CO+H2 ΔH>0达到平衡后,由于条件改变而引起正、逆反应速率的变化以及平衡移动的情况。下列说法错误的是
CO+H2 ΔH>0达到平衡后,由于条件改变而引起正、逆反应速率的变化以及平衡移动的情况。下列说法错误的是
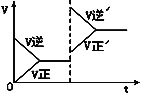
A. 起始反应物为CO和H2
B. 改变条件后平衡逆向移动
C. 改变的条件是增大压强
D. 新平衡时CO的浓度比原平衡小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属及其化合物的种类很多,我们可以按照“金属单质、金属氧化物、金属氢氧化物、盐”的类别进行研究。以下是元素周期表中前18号某种金属元素对应的单质及其化合物之间的转化关系(“→”所指的转化都是一步完成)。
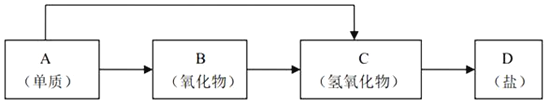
(1)若B为呼吸面具中的供氧剂,其供氧时每生成1molO2,反应过程中转移的电子数为___________________,A与水反应的离子方程式为:_____________________。
(2)200℃时,11.6g CO2和H2O的混合物气体与足量的B反应,反应后固体增加了3.6g,则原混合物的平均相对分子质量为______________。
(3)写出一种“C→D”转化的离子方程式:___________________________________。
(4)某同学将一小块A单质露置于空气中,观察到下列现象:
银白色![]() 变灰暗
变灰暗![]() 变白色
变白色![]() 出现液滴
出现液滴![]() 白色固体
白色固体
则下列说法正确的是_____________________。
A.①发生了氧化还原反应
B.①变灰暗色是因为生成了过氧化钠
C.③是碳酸钠吸收空气中的水蒸气形成了溶液
D.④只发生物理变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据所学知识填写下列空白。
(1)已知拆开1mol H-H键,1mol N-H键,1mol N≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成1mol NH3的反应热ΔH =__________________。
(2)氢气的燃烧热为286kJ/mol。写出表示氢气燃烧热的热化学方程式____________________________________________。
(3)某温度下纯水中的c(H+) = 1×10-6.5mol/L。若温度不变,滴入稀硫酸使c(H+)= 5×10-5mol/L,则由水电离出的c(H+) =__________mol/L。
(4)已知在第(3)问条件下,盐酸的pH=a,氢氧化钡的pH=b。若酸碱按体积比1:10混合后溶液显中性,则a+b=_________。
(5)某二元酸(化学式用H2B表示)在水中的电离方程式是H2B=H++HB-, HB- ![]() H++B2-。
H++B2-。
已知0.1 mol/L NaHB溶液的pH=2,则0.1 mol/L H2B溶液中c(H+)小于0.11 mol/L的原因是____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸合铁酸钾晶体Kx[Fe(C2O4)y]·3H2O 是一种光敏材料,见光易分解,下面是一种制备草酸合铁酸钾晶体的实验流程。
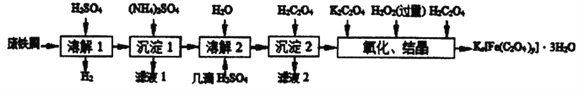
已知:(NH4)SO4、FeSO4·7H2O、莫尔盐[(NH4)2SO4·FeSO4·6H2O]的溶解度如表:
温度/℃ | 10 | 20 | 30 | 40 | 50 |
(NH4)SO4/g | 73.0 | 75.4 | 78.0 | 81.0 | 84.5 |
FeSO4·7H2O/g | 40.0 | 48.0 | 60.0 | 73.3 | — |
(NH4)2SO4·FeSO4·6H2O/g | 18.1 | 21.2 | 24.5 | 27.9 | 31.3 |
(1)废铁屑在进行“溶解1”前,得用在5%Na2CO3溶液中加热数分钟,并洗涤干净.Na2CO3溶液的作用是___________________。
(2)“复分解”制备莫尔盐晶体的基本实验步骤是: 蒸发浓缩、_________、过滤、用乙醇洗涤、干燥。用乙醇洗涤的目的是_________ 。
(3)“沉淀2"时得到的FeC2O4·2H2O 沉淀需用水洗涤干净.检验沉淀是否洗涤干净的方法是_____。
(4)“结晶”时应将溶液放在黑暗处等待晶体的析出,这样操作的原因是_________ 。
(5)为测定该晶体中铁的含量,某实验小组做了如下实验:
步骤1: 准确称量5.00g 草酸合铁酸钾晶体,配制成250mL 溶液
步骤2:取所配溶液25.00 mL于锥形瓶中,加稀H2SO4酸化,滴加KMnO4溶液至草酸根恰好全部氧化成二氧化碳,同时,MnO4-被还原成Mn2+。向反应后的溶液中加入一小匙锌粉,加热至黄色刚好消失,过滤,洗涤,将过滤及洗涤所得溶液收集到锥形瓶中,此时,溶液仍呈酸性。
步骤3:用0.010mol/L KMnO4溶液滴定步骤2所得溶液至终点,消耗KMnO4溶液20.02mL,滴定中MnO4-被还原成Mn2+.重复步骤2、步骤3 操作,滴定消耗 0.010mol/LKMnO4溶液19.98mL,实验测得该晶体中铁的质量分数为_____ (写出计算过程)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com