
【题目】草酸合铁酸钾晶体Kx[Fe(C2O4)y]·3H2O 是一种光敏材料,见光易分解,下面是一种制备草酸合铁酸钾晶体的实验流程。
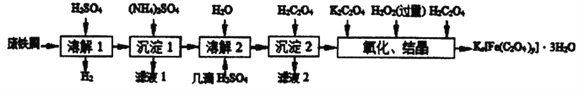
已知:(NH4)SO4、FeSO4·7H2O、莫尔盐[(NH4)2SO4·FeSO4·6H2O]的溶解度如表:
温度/℃ | 10 | 20 | 30 | 40 | 50 |
(NH4)SO4/g | 73.0 | 75.4 | 78.0 | 81.0 | 84.5 |
FeSO4·7H2O/g | 40.0 | 48.0 | 60.0 | 73.3 | — |
(NH4)2SO4·FeSO4·6H2O/g | 18.1 | 21.2 | 24.5 | 27.9 | 31.3 |
(1)废铁屑在进行“溶解1”前,得用在5%Na2CO3溶液中加热数分钟,并洗涤干净.Na2CO3溶液的作用是___________________。
(2)“复分解”制备莫尔盐晶体的基本实验步骤是: 蒸发浓缩、_________、过滤、用乙醇洗涤、干燥。用乙醇洗涤的目的是_________ 。
(3)“沉淀2"时得到的FeC2O4·2H2O 沉淀需用水洗涤干净.检验沉淀是否洗涤干净的方法是_____。
(4)“结晶”时应将溶液放在黑暗处等待晶体的析出,这样操作的原因是_________ 。
(5)为测定该晶体中铁的含量,某实验小组做了如下实验:
步骤1: 准确称量5.00g 草酸合铁酸钾晶体,配制成250mL 溶液
步骤2:取所配溶液25.00 mL于锥形瓶中,加稀H2SO4酸化,滴加KMnO4溶液至草酸根恰好全部氧化成二氧化碳,同时,MnO4-被还原成Mn2+。向反应后的溶液中加入一小匙锌粉,加热至黄色刚好消失,过滤,洗涤,将过滤及洗涤所得溶液收集到锥形瓶中,此时,溶液仍呈酸性。
步骤3:用0.010mol/L KMnO4溶液滴定步骤2所得溶液至终点,消耗KMnO4溶液20.02mL,滴定中MnO4-被还原成Mn2+.重复步骤2、步骤3 操作,滴定消耗 0.010mol/LKMnO4溶液19.98mL,实验测得该晶体中铁的质量分数为_____ (写出计算过程)。
【答案】 去除油污 冷却结晶 洗去晶体表面杂质,减少莫尔盐晶体溶解损失,乙醇易挥发,有利于晶体快速干燥,降低能耗。 用小试管取少量最后一次洗涤滤液,加入BaCl2 溶液。如出现白色沉淀,说明沉淀没有洗涤干净,反之,沉淀已洗涤干净 黑暗可以防止晶体分解 11.20%或0.112
【解析】废铁屑加入硫酸溶液溶解,加入硫酸铵溶液结晶析出硫酸亚铁晶体,加水溶解,滴入几滴稀硫酸防止亚铁离子水解,加入草酸沉淀亚铁离子,过滤得到沉淀加入重铬酸钾、过氧化氢溶液氧化加入草酸得到草酸合铁酸钾晶体。
(1)在5%Na2CO3溶液中加热数分钟,并洗涤干净是利用碳酸钠水解显碱性,油污会发生水解生成溶于水的物质洗去,作用是去除油污;故答案为:除油污;
(2)复分解”制备莫尔盐晶体的基本实验步骤是:蒸发浓缩,冷却结晶,过滤用乙醇洗涤、干燥,防止生成的盐损失,乙醇易挥发;故答案为:冷却结晶,洗去晶体表面杂质,减少莫尔盐晶体溶解损失,便于快速干燥,降低能耗;
(3)取最后一次洗涤液,检查是否含有硫酸根离子进行设计分析,用小试管取少量最后一次洗涤液,加入BaCl2溶液,如出现白色沉淀,说明沉淀没有洗涤干净,否则,沉淀已洗涤干净;故答案为:用小试管取少量最后一次洗涤液,加入BaCl2溶液,如出现白色沉淀,说明沉淀没有洗涤干净,否则,沉淀已洗涤干净;
(4)“结晶”时应将溶液放在黑暗处等待晶体的析出,这样操作的原因是黑暗可以防止晶体分解;故答案为:黑暗可以防止晶体分解;
(5)步骤3中发生的反应为5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O,2次滴定消耗的高锰酸钾溶液的体积平均为20.00mL,则n(Fe2+)=5 n(MnO4-)=0.010mol/L×0.0200L×5=0.001mol,晶体中铁的质量分数为![]() ×100%=11.2%,故答案为:11.2%。
×100%=11.2%,故答案为:11.2%。


 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案科目:高中化学 来源: 题型:
【题目】反应4A(s)+3B(g)=2C(g)+D(g),经2min B的浓度减少0.6 mol/L。有关反应速率的说法正确的是
A. 用A表示的反应速率是0.4 mol/(L·min)
B. 分别用A、B、C、D表示反应的速率,其比值是4:3:2:1
C. 2 min内的反应速率,用B表示是0.3 mol/(L·min)
D. 在这2 min内用B和C表示的反应速率的值都是逐渐减小的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验现象与对应化学方程式都正确的是( )
A. 钠投入水中,浮在水面熔成小球,在水面快速移动,得到的溶液显碱性;2 Na + 2 H2O ![]() 2 NaOH + H2↑
2 NaOH + H2↑
B. 氢气在氯气中安静的燃烧,发出淡蓝色火焰,瓶口出现白雾;H2 + Cl2 ![]() 2HCl
2HCl
C. FeSO4溶液中加入NaOH溶液时,生成的白色絮状沉淀迅速变为灰绿色,最后变成红褐色; 2Fe(OH)2 + O2 + H2O ![]() 2 Fe(OH)3
2 Fe(OH)3
D. 向Na2SiO3溶液中逐滴加入稀盐酸,边加边振荡,有硅酸胶体产生;Na2SiO3 + 2HCl ![]() H2SiO3+ 2NaCl
H2SiO3+ 2NaCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在标准状况下①6.72L CH4 ②3.01×1023个HCl分子③ 13.6g H2S ④0.2mol NH3, 下列对这四种气体的关系从大到小表达正确的是_____
a.体积②>③>①>④ b.密度②>③>④>①
c.质量②>③>①>④ d.氢原子个数①>③>④>②
(2)在标准状况下,CO和CO2的混合气体共39.2 L,质量为61 g。则其中CO2为________mol, CO占总体积的______(保留一位小数),混合气体的摩尔质量为_______(保留一位小数)。
(3)某混合气体中各气体的质量分数为:O232%,N228%,CO222%,CH416%,H22%,则此混合气体的平均摩尔质量为______(保留两位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用图示装置完成相关实验合理的是
选项 | ①中物质 | ②中物质 | 实验目的 | 装置 |
A | 乙醇 | K2Cr2O7溶液 | 验证乙醇的还原性 |
|
B | 浓盐酸 | KMnO4固体 | 制取并收集氯气 | |
C | 少量氯化铝溶液 | 浓氢氧化钠溶液 | 制取氢氧化铝沉淀 | |
D | 稀硝酸 | 铜粉 | 制取并收集NO |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钙是一种阻锈剂,可用于染料工业,某兴趣小组拟制备Ca(NO2)2并对其性质进行探究。
(背景素材)
Ⅰ.NO+NO2+Ca(OH)2=Ca(NO2)2+H2O。
Ⅱ.Ca(NO2)2能被酸性KMnO4溶液氧化成NO3—,MnO4—被还原为Mn2+。
Ⅲ.在酸性条件下,Ca(NO2)2能将I氧化为I2,S2O32—能将I2还原为I。
(制备氮氧化物)
(1)甲组同学拟利用如下左图所示装置制备氮氧化物。

①仪器X、Y的名称分别是______________、______________。
②装置B中逸出的NO与NO2的物质的量之比为1∶1,则装置B中发生反应的化学方程式为______,若其他条件不变,增大硝酸的浓度,则会使逸出的气体中n(NO2)__________n(NO)(填“>”或“<”)。
(制备Ca(NO2)2)
(2)乙组同学拟利用装置B中产生的氮氧化物制备Ca(NO2)2,装置如上右图。
①装置C中导管末端接一玻璃球的作用是________________。
②装置D的作用是______________;装置E的作用是________________。
(测定Ca(NO2)2的纯度)
(3)丙组同学拟测定Ca(NO2)2的纯度(杂质不参加反应),可供选择的试剂:
a.稀硫酸 b.c1mol·L1的KI溶液 c.淀粉溶液 d.c2 mol·L1的Na2S2O3溶液 e.c3mol·L1的酸性KMnO4溶液
①利用Ca(NO2)2的还原性来测定其纯度,可选择的试剂是__________(填字母)。
②利用Ca(NO2)2的氧化性来测定其纯度的步骤:准确称取mgCa(NO2)2样品放入锥形瓶中,加适量水溶解,_______(请补充完整实验步骤)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空:
(1)48gCH4其摩尔质量为___________________,含有______________mol电子,在标准状况下所占体积约为____________L。
(2)等物质的量浓度的Ca(OH)2溶液与NaHCO3溶液按体积比1:2混合,混合之后的溶液发生反应的离子方程式为:____________________________________________________________。
(3)制备氢氧化铁胶体的离子方程式:____________________________________。
(4)写出H++HCO3-=H2O+CO2↑对应的一个化学方程式:____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】基于CaSO4为载氧体的天然气燃烧是一种新型绿色的燃烧方式,CaSO4作为氧和热量的有效载体,能够高效低能耗地实现CO2的分离和捕获其原理如下图所示:
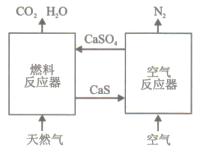
(1)已知在燃料反应器中发生如下反应:
i.4CaSO4(s)+CH4(g)=4CaO(s)+CO2(g)+4SO2(g)+2H2O(g) ΔH1=akJ/mol
ii.CaSO4(s)+CH4(g)=CaS(s)+CO2(g)+2H2O(g) ΔH2=bkJ/mol
ⅲ. CaS(s)+3CaSO4(s)= 4CaO(s)+4SO2(g) ΔH3=ckJ/mol
①燃料反应器中主反应为_________(填“i”“ii”或“ⅲ”)。
②反应i和ii的平衡常数Kp与温度的关系如图1,则a_______0(填“ >”“ =“或“<” );720℃时反应ⅲ的平衡常数Kp=________。
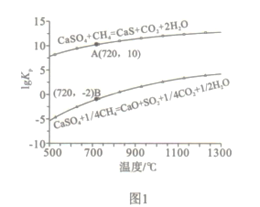
③下列措施可提高反应ii中甲烷平衡转化率的是_______。
A.增加CaSO4固体的投入量 B.将水蒸气冷凝
C.降温 D.增大甲烷流量
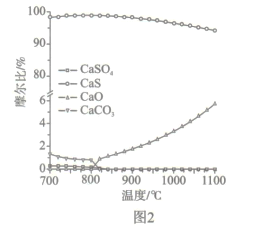
(2)如图2所示,该燃料反应器最佳温度范围为850℃ -900℃之间,从化学反应原理的角度说明原因:_______。
(3)空气反应器中发生的反应为
CaS(s) +2O2(g)=CaSO4(s) ΔH4=dkJ/mol
①根据热化学原理推测该反应为__________反应。
②在天然气燃烧过程中,可循环利用的物质为________。
(4)该原理总反应的热化学方程式为____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镧系金属元素鈰(Ce)常见有+3、+4两种价态,鈰的合金耐高温,可以用来制造喷气推进器零件。请回答下列问题:
(1)雾霾中含有的污染物NO可以被含Ce4+的溶液吸收,生成![]() 物质的量之比为1∶1,试写出该反应的离子方程式______________________________________________。
物质的量之比为1∶1,试写出该反应的离子方程式______________________________________________。
(2)用电解的方法可将上述吸收液中的![]() 转化为稳定的无毒气体,同时再生Ce4+,其原理如图所示。
转化为稳定的无毒气体,同时再生Ce4+,其原理如图所示。
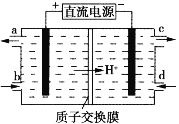
①无毒气体从电解槽的___________(填字母序号)口逸出。
②每生成标准状况下22.4 L无毒气体,同时可再生Ce4+_____________mol。
(3)鈰元素在自然界中主要以氟碳鈰矿形式存在,其主要化学成分为CeFCO3。工业上利用氟碳鈰矿提取CeCl3的一种工艺流程如下:
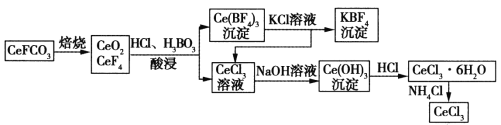
①焙烧过程中发生的主要反应的氧化剂和还原剂的物质的量之比为______________。
②假设参与酸浸反应的CeO2和CeF4的物质的量之比为3∶1,试写出相应的化学方程式________________________________________。
③向Ce(BF4)3中加入KCl溶液的目的是________________________________________。
④常温下,当溶液中的某离子浓度![]() 时,可认为该离子沉淀完全。据此,在生成Ce(OH)3的反应中,加入NaOH溶液至pH至少达到____________时,即可视为Ce3 +已完全沉淀。
时,可认为该离子沉淀完全。据此,在生成Ce(OH)3的反应中,加入NaOH溶液至pH至少达到____________时,即可视为Ce3 +已完全沉淀。![]()
⑤加热CeCl3·6H2O和NH4Cl的固体混合物可得固体无水CeCl3,其中NH4Cl的作用是______________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com