
【题目】按要求填空:
(1)48gCH4其摩尔质量为___________________,含有______________mol电子,在标准状况下所占体积约为____________L。
(2)等物质的量浓度的Ca(OH)2溶液与NaHCO3溶液按体积比1:2混合,混合之后的溶液发生反应的离子方程式为:____________________________________________________________。
(3)制备氢氧化铁胶体的离子方程式:____________________________________。
(4)写出H++HCO3-=H2O+CO2↑对应的一个化学方程式:____________________________________。
【答案】16g/mol 30 67.2 Ca2++2OH-+2HCO3-=CaCO3↓+2H2O+CO32- Fe3++3H2O ![]() Fe(OH)3(胶体)+3H+ HCl+NaHCO3=H2O+CO2↑+NaCl
Fe(OH)3(胶体)+3H+ HCl+NaHCO3=H2O+CO2↑+NaCl
【解析】
(1)CH4的摩尔质量为16g/mol,48gCH4含有![]() 电子,在标准状况下所占体积约为
电子,在标准状况下所占体积约为![]() ×22.4L/mol=67.2L;
×22.4L/mol=67.2L;
正确答案:16g/mol;30;67.2。
(2)等物质的量浓度的Ca(OH)2溶液与NaHCO3溶液按体积比1:2混合,也就是按物质的量之比1:2混合,混合之后的溶液发生反应的离子方程式为Ca2++2OH-+2HCO3-=CaCO3↓+2H2O+CO32-;
正确答案:Ca2++2OH-+2HCO3-=CaCO3↓+2H2O+CO32-。
(3)向沸腾的蒸馏水中逐滴加入1~2mL饱和FeCl3溶液,继续煮沸至液体呈红褐色,停止加热,制备氢氧化铁胶体,所以离子方程式为Fe3++3H2O![]() Fe(OH)3(胶体)+3H+;
Fe(OH)3(胶体)+3H+;
正确答案:Fe3++3H2O ![]() Fe(OH)3(胶体)+3H+。
Fe(OH)3(胶体)+3H+。
(4)H++HCO3-=H2O+CO2↑对应的一个化学方程式,应该选择强酸与易溶于水的碳酸氢盐,所以化学方程式为HCl+NaHCO3=NaCl+CO2↑+H2O;
正确答案:HCl+NaHCO3=NaCl+CO2↑+H2O。


科目:高中化学 来源: 题型:
【题目】金属及其化合物的种类很多,我们可以按照“金属单质、金属氧化物、金属氢氧化物、盐”的类别进行研究。以下是元素周期表中前18号某种金属元素对应的单质及其化合物之间的转化关系(“→”所指的转化都是一步完成)。
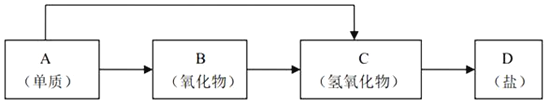
(1)若B为呼吸面具中的供氧剂,其供氧时每生成1molO2,反应过程中转移的电子数为___________________,A与水反应的离子方程式为:_____________________。
(2)200℃时,11.6g CO2和H2O的混合物气体与足量的B反应,反应后固体增加了3.6g,则原混合物的平均相对分子质量为______________。
(3)写出一种“C→D”转化的离子方程式:___________________________________。
(4)某同学将一小块A单质露置于空气中,观察到下列现象:
银白色![]() 变灰暗
变灰暗![]() 变白色
变白色![]() 出现液滴
出现液滴![]() 白色固体
白色固体
则下列说法正确的是_____________________。
A.①发生了氧化还原反应
B.①变灰暗色是因为生成了过氧化钠
C.③是碳酸钠吸收空气中的水蒸气形成了溶液
D.④只发生物理变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,两瓶体积相等的气体,在同温同压时瓶内气体(N2O和CO2不发生化学反应)的关系不正确的是
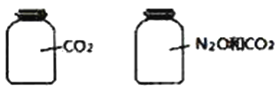
A. 所含氧原子数相等 B. 气体的总质量相等
C. 气体所含电子总数相等 D. 气体的密度相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸合铁酸钾晶体Kx[Fe(C2O4)y]·3H2O 是一种光敏材料,见光易分解,下面是一种制备草酸合铁酸钾晶体的实验流程。
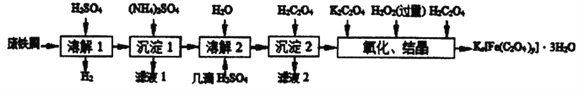
已知:(NH4)SO4、FeSO4·7H2O、莫尔盐[(NH4)2SO4·FeSO4·6H2O]的溶解度如表:
温度/℃ | 10 | 20 | 30 | 40 | 50 |
(NH4)SO4/g | 73.0 | 75.4 | 78.0 | 81.0 | 84.5 |
FeSO4·7H2O/g | 40.0 | 48.0 | 60.0 | 73.3 | — |
(NH4)2SO4·FeSO4·6H2O/g | 18.1 | 21.2 | 24.5 | 27.9 | 31.3 |
(1)废铁屑在进行“溶解1”前,得用在5%Na2CO3溶液中加热数分钟,并洗涤干净.Na2CO3溶液的作用是___________________。
(2)“复分解”制备莫尔盐晶体的基本实验步骤是: 蒸发浓缩、_________、过滤、用乙醇洗涤、干燥。用乙醇洗涤的目的是_________ 。
(3)“沉淀2"时得到的FeC2O4·2H2O 沉淀需用水洗涤干净.检验沉淀是否洗涤干净的方法是_____。
(4)“结晶”时应将溶液放在黑暗处等待晶体的析出,这样操作的原因是_________ 。
(5)为测定该晶体中铁的含量,某实验小组做了如下实验:
步骤1: 准确称量5.00g 草酸合铁酸钾晶体,配制成250mL 溶液
步骤2:取所配溶液25.00 mL于锥形瓶中,加稀H2SO4酸化,滴加KMnO4溶液至草酸根恰好全部氧化成二氧化碳,同时,MnO4-被还原成Mn2+。向反应后的溶液中加入一小匙锌粉,加热至黄色刚好消失,过滤,洗涤,将过滤及洗涤所得溶液收集到锥形瓶中,此时,溶液仍呈酸性。
步骤3:用0.010mol/L KMnO4溶液滴定步骤2所得溶液至终点,消耗KMnO4溶液20.02mL,滴定中MnO4-被还原成Mn2+.重复步骤2、步骤3 操作,滴定消耗 0.010mol/LKMnO4溶液19.98mL,实验测得该晶体中铁的质量分数为_____ (写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O中,氧化剂和还原剂物质的量之比为1:4
MnCl2+Cl2↑+2H2O中,氧化剂和还原剂物质的量之比为1:4
B. KClO3+6HCl=KCl+3Cl2↑+2H2O,氧化剂和还原剂物质的量之比为1:5
C. 2H2S+SO2=3S+2H2O中,氧化产物和还原产物物质的量之比为1:1
D. 3S+6KOH=2K2S+K2SO3+3H2O中被氧化和被还原的硫元素物质的量之比为2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素R、X、Y、Z 在周期表中的相对位置如图所示。已知: Y的最高价氧化物对应的水化物既能与强碱反应,又能与强酸反应。下列说法不正确的是
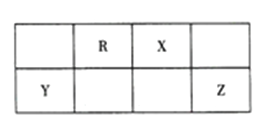
A. 简单气态氢化物的热稳定性: R<X
B. Y、Z的简单离子在同一溶液中能大量共存
C. 工业上,采用电解法冶炼单质Y
D. RZ2是含极性键的共价化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】古老但仍然是最有用的制备联氨(N2H4)溶液的方法如下: NaClO+ NH3H2O—— N2H4+ NaCl+ H2O
(1)请配平上述化学方程式,并用单线桥法标出电子转移的方向和数目。__________
(2)NH3H2O在上述反应中显示出来的性质是__________。
A.氧化性 B.还原性
C.酸性 D.碱性
(3)当转移10mol电子时,被氧化的物质的质量为__________。
(4)NH3H2O的电离方程式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有常见的A~J物质存在如下转化关系示意图(反应条件已略去),已知通常情况下A为固态金属单质,B、D为气态非金属单质,E为淡黄色固体,F为无色液体,J为红褐色沉淀。请回答下列问题:
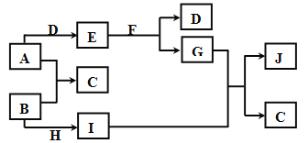
(1)写出下列物质的化学式:H________;D__________。
(2)写出下列转化的化学方程式或离子方程式:
①E+F→D+G的化学方程式:__________________________________;
②G+I→C+J的离子方程式:_________________________________。
(3)若要检验I物质的阳离子所加入的试剂是________________________。实验现象为:_______________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知![]() 与足量的10mol/L硫酸液混合微热,产生下列现象:①有红色金属生成②产生刺激性气味的气体③溶液呈现蓝色。据此判断下列说法正确的是
与足量的10mol/L硫酸液混合微热,产生下列现象:①有红色金属生成②产生刺激性气味的气体③溶液呈现蓝色。据此判断下列说法正确的是
A. 反应中硫酸作氧化剂
B. ![]() 中硫元素被氧化
中硫元素被氧化
C. 刺激性气味的气体是氨气
D. 1mol![]() 完全反应转移0.5mol电子
完全反应转移0.5mol电子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com