
【题目】古老但仍然是最有用的制备联氨(N2H4)溶液的方法如下: NaClO+ NH3H2O—— N2H4+ NaCl+ H2O
(1)请配平上述化学方程式,并用单线桥法标出电子转移的方向和数目。__________
(2)NH3H2O在上述反应中显示出来的性质是__________。
A.氧化性 B.还原性
C.酸性 D.碱性
(3)当转移10mol电子时,被氧化的物质的质量为__________。
(4)NH3H2O的电离方程式为__________。
【答案】![]() B 350g NH3·H2O
B 350g NH3·H2O![]() NH4++OH-
NH4++OH-
【解析】
(1)①利用化合价升降相等配平化合价发生变化的元素,②利用左右两边原子守恒配平其他元素,单线桥法箭头由失电子一方(还原剂)指向得电子一方(氧化剂),所以![]() ;
;
正确答案:![]() 。
。
(2)上述反应NH3H2O中氮元素的化合价升高,显示还原性;
正确答案:B。
(3)反应中N元素的化合价由-3价升高到-2价,1molNH3H2O被氧化转移1mol电子,若反应中转移10mol电子,则应有10molNH3H2O参加反应,质量为10mol×35g/mol=350g;
正确答案:350g。
(4)NH3H2O为弱电解质,存在电离平衡,故电离方程式为NH3·H2O![]() NH4++OH-;
NH4++OH-;
正确答案:NH3·H2O![]() NH4++OH-。
NH4++OH-。


科目:高中化学 来源: 题型:
【题目】室温下,浓度均为0.1mol·L-1、体积均为Vo的HA、HB溶液,分别加水稀释至V,pH随![]() 的变化如图所示,下列说法正确的是
的变化如图所示,下列说法正确的是
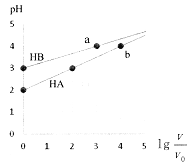
A. HA为强酸,HB为弱酸 B. 水的电离程度a点大于b点
C. 当pH=2时,HA溶液中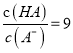 D. 等浓度等体积的HB与Na0H溶液充分反应后,离子浓度关系大小为:c(B-)> c(Na+)>c(H+)>c(OH-)
D. 等浓度等体积的HB与Na0H溶液充分反应后,离子浓度关系大小为:c(B-)> c(Na+)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用图示装置完成相关实验合理的是
选项 | ①中物质 | ②中物质 | 实验目的 | 装置 |
A | 乙醇 | K2Cr2O7溶液 | 验证乙醇的还原性 |
|
B | 浓盐酸 | KMnO4固体 | 制取并收集氯气 | |
C | 少量氯化铝溶液 | 浓氢氧化钠溶液 | 制取氢氧化铝沉淀 | |
D | 稀硝酸 | 铜粉 | 制取并收集NO |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空:
(1)48gCH4其摩尔质量为___________________,含有______________mol电子,在标准状况下所占体积约为____________L。
(2)等物质的量浓度的Ca(OH)2溶液与NaHCO3溶液按体积比1:2混合,混合之后的溶液发生反应的离子方程式为:____________________________________________________________。
(3)制备氢氧化铁胶体的离子方程式:____________________________________。
(4)写出H++HCO3-=H2O+CO2↑对应的一个化学方程式:____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为检验某加碘食盐中是否含有KIO3,取相同食盐样品进行下表所示实验:
(已知:KIO3 + 5KI + 3H2SO4![]() 3I2 + 3K2SO4 + 3H2O)
3I2 + 3K2SO4 + 3H2O)
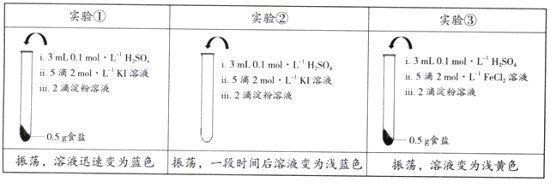
下列说法中正确的是
A. 仅由实验①就能证明食盐样品中存在KIO3
B. 实验②中发生反应的离子方程式为4I-+ O2 + 4H+ ![]() 2I2 + 2H2O
2I2 + 2H2O
C. 实验③能证明食盐样品中不存在KIO3
D. 以上实验说明离子的还原性:I- > Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】基于CaSO4为载氧体的天然气燃烧是一种新型绿色的燃烧方式,CaSO4作为氧和热量的有效载体,能够高效低能耗地实现CO2的分离和捕获其原理如下图所示:
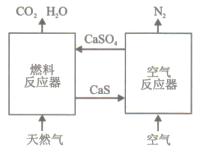
(1)已知在燃料反应器中发生如下反应:
i.4CaSO4(s)+CH4(g)=4CaO(s)+CO2(g)+4SO2(g)+2H2O(g) ΔH1=akJ/mol
ii.CaSO4(s)+CH4(g)=CaS(s)+CO2(g)+2H2O(g) ΔH2=bkJ/mol
ⅲ. CaS(s)+3CaSO4(s)= 4CaO(s)+4SO2(g) ΔH3=ckJ/mol
①燃料反应器中主反应为_________(填“i”“ii”或“ⅲ”)。
②反应i和ii的平衡常数Kp与温度的关系如图1,则a_______0(填“ >”“ =“或“<” );720℃时反应ⅲ的平衡常数Kp=________。
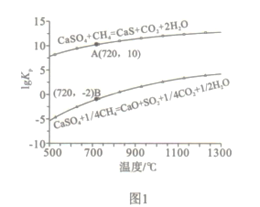
③下列措施可提高反应ii中甲烷平衡转化率的是_______。
A.增加CaSO4固体的投入量 B.将水蒸气冷凝
C.降温 D.增大甲烷流量
(2)如图2所示,该燃料反应器最佳温度范围为850℃ -900℃之间,从化学反应原理的角度说明原因:_______。
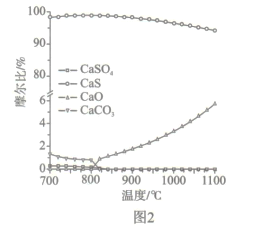
(3)空气反应器中发生的反应为
CaS(s) +2O2(g)=CaSO4(s) ΔH4=dkJ/mol
①根据热化学原理推测该反应为__________反应。
②在天然气燃烧过程中,可循环利用的物质为________。
(4)该原理总反应的热化学方程式为____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.近年来,我国储氧纳米碳管研究获重大进展,电弧法合成的碳纳米管,常伴有大量物质——碳纳米颗粒.这种碳纳米颗粒可用氧化气化法提纯.其反应的化学方程式为:3C+2K2Cr2O7+8H2SO4(稀)=3CO2+2K2SO4+2Cr2(SO4)3 +4H2O
(1)标出以上化学方程式转移电子的方向和数目___________。
(2)此反应的氧化剂是__________,氧化产物是____________;
(3)上述反应中若产生22g气体物质,则转移电子的数目为___________。
II.用质量分数为36.5%的浓盐酸(密度为1.20 g·cm-3)配制成0.5mol·L-1的稀盐酸。现实验室仅需要这种盐酸250mL,试回答下列问题:
(1)配制稀盐酸时,所需的仪器除烧杯、玻璃棒、胶头滴管外还需要的玻璃仪器有___________;
(2)此浓盐酸的物质的量浓度是_____________;
(3)经计算需要_______mL浓盐酸;
(4)某学生在上述配制过程中,下列操作会引起浓度偏低的是______________。
A.若未用蒸馏水洗涤烧杯内壁和玻璃棒或未将洗涤液注入容量瓶。
B.定容时,俯视容量瓶的刻度线
C.容量瓶用水洗涤后没有干燥就直接进行配制
D.定容时不小心加水超过刻度线,用胶头滴管取出多余的水,使液面好到达刻度线。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组中的离子,能在溶液中大量共存的是
A. K+、H+、SO![]() 、OH- B. Na+、Ca2+、CO
、OH- B. Na+、Ca2+、CO![]() 、NO
、NO![]()
C. Na+、H+、Cl-、CO![]() D. Na+、Cu2+、Cl-、SO
D. Na+、Cu2+、Cl-、SO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下的定容容器中,当下列哪些物理量不再发生变化时,表明反应:
A(s)+2B(g)![]() C(g)+D(g)已达到平衡状态的是( )
C(g)+D(g)已达到平衡状态的是( )
① 混合气体的压强;② 混合气体的密度;③ B的物质的量浓度;④ 气体总物质的量;⑤ 混合气体的平均相对分子质量;⑥ C、D反应速率的比值
A. ②③⑤ B. ①②③ C. ②③④⑥ D. ①③④⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com