
【题目】运用图示装置完成相关实验合理的是
选项 | ①中物质 | ②中物质 | 实验目的 | 装置 |
A | 乙醇 | K2Cr2O7溶液 | 验证乙醇的还原性 |
|
B | 浓盐酸 | KMnO4固体 | 制取并收集氯气 | |
C | 少量氯化铝溶液 | 浓氢氧化钠溶液 | 制取氢氧化铝沉淀 | |
D | 稀硝酸 | 铜粉 | 制取并收集NO |
A. A B. B C. C D. D
【答案】A
【解析】
A.乙醇能被酸性重铬酸钾溶液直接氧化为乙酸;B.浓盐酸与KMnO4固体常温下制备氯气应该选用分液漏斗,应该有尾气吸收装置;C.氢氧化铝为两性氢氧化物,能溶于氢氧化钠溶液;NO能与空气中氧气反应,不能用排空气法收集。
A项,将乙醇加入K2Cr2O7溶液中,若溶液颜色由橙色变为绿色,则可证明乙醇具有还原性,正确;B项,浓盐酸与KMnO4固体常温下可反应生成氯气,但氯气和挥发的氯化氢气体都会向空气中扩散导致空气污染,错误;C项,少量氯化铝和氢氧化钠反应得到偏铝酸钠,错误;D项,发生装置应该使用分液漏斗(防止NO向空气中扩散),且收集方法应该使用排水集气法,错误。
故选A。


科目:高中化学 来源: 题型:
【题目】锂-空气电池原理模型如图所示,下列说法不正确的是

A. 电池正极可以吸附空气中氧气作为氧化剂
B. 正极反应为2Li+ + O2 + 2e- ![]() Li2O2
Li2O2
C. 电解质能传递锂离子和电子,不可以用水溶液
D. 负极反应Li - e-=Li+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有失去标签的甲、乙、丙、丁四瓶溶液,它们分別是Ba(NO3)2、H2SO4、Na2SO4、K2CO3的一种,为了鉴别他们,进行了如下实验:
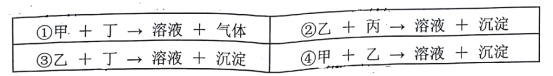
在④得到的沉淀中加入足量稀盐酸,沉淀迅速溶解,并产生无色无味的气体。
根据以上实验事实,回答下列问题:
(1)从④得到沉淀所使用的玻璃仪器有__________________________。
(2)乙、丁的名称分别是:乙_______________,丁_____________。
(3)请写出在④得到的沉淀中加入足量稀盐酸的离子反应方程式__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,两瓶体积相等的气体,在同温同压时瓶内气体(N2O和CO2不发生化学反应)的关系不正确的是
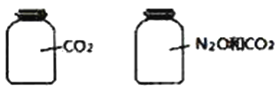
A. 所含氧原子数相等 B. 气体的总质量相等
C. 气体所含电子总数相等 D. 气体的密度相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有铁、碳两种元素组成的合金,某实验小组为了研究该合金的性质并测定该合金中碳的质量分数,设计了如下实验方案和实验装置:

(1)取ag合金粉末放入蒸馏烧瓶,并加入足量浓硫酸,A、B中均无明显现象,原因是________________________________________________。
(2)反应一段时间后,B中的现象为___________________________。
(3)装置C的作用是________________;装置D的作用是___________,F的作用是___________________________________________。
(4)反应结束后,若U形管E增重m g,则合金中碳的质量分数为________。(用含m和a的式子表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸合铁酸钾晶体Kx[Fe(C2O4)y]·3H2O 是一种光敏材料,见光易分解,下面是一种制备草酸合铁酸钾晶体的实验流程。
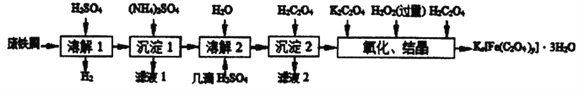
已知:(NH4)SO4、FeSO4·7H2O、莫尔盐[(NH4)2SO4·FeSO4·6H2O]的溶解度如表:
温度/℃ | 10 | 20 | 30 | 40 | 50 |
(NH4)SO4/g | 73.0 | 75.4 | 78.0 | 81.0 | 84.5 |
FeSO4·7H2O/g | 40.0 | 48.0 | 60.0 | 73.3 | — |
(NH4)2SO4·FeSO4·6H2O/g | 18.1 | 21.2 | 24.5 | 27.9 | 31.3 |
(1)废铁屑在进行“溶解1”前,得用在5%Na2CO3溶液中加热数分钟,并洗涤干净.Na2CO3溶液的作用是___________________。
(2)“复分解”制备莫尔盐晶体的基本实验步骤是: 蒸发浓缩、_________、过滤、用乙醇洗涤、干燥。用乙醇洗涤的目的是_________ 。
(3)“沉淀2"时得到的FeC2O4·2H2O 沉淀需用水洗涤干净.检验沉淀是否洗涤干净的方法是_____。
(4)“结晶”时应将溶液放在黑暗处等待晶体的析出,这样操作的原因是_________ 。
(5)为测定该晶体中铁的含量,某实验小组做了如下实验:
步骤1: 准确称量5.00g 草酸合铁酸钾晶体,配制成250mL 溶液
步骤2:取所配溶液25.00 mL于锥形瓶中,加稀H2SO4酸化,滴加KMnO4溶液至草酸根恰好全部氧化成二氧化碳,同时,MnO4-被还原成Mn2+。向反应后的溶液中加入一小匙锌粉,加热至黄色刚好消失,过滤,洗涤,将过滤及洗涤所得溶液收集到锥形瓶中,此时,溶液仍呈酸性。
步骤3:用0.010mol/L KMnO4溶液滴定步骤2所得溶液至终点,消耗KMnO4溶液20.02mL,滴定中MnO4-被还原成Mn2+.重复步骤2、步骤3 操作,滴定消耗 0.010mol/LKMnO4溶液19.98mL,实验测得该晶体中铁的质量分数为_____ (写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O中,氧化剂和还原剂物质的量之比为1:4
MnCl2+Cl2↑+2H2O中,氧化剂和还原剂物质的量之比为1:4
B. KClO3+6HCl=KCl+3Cl2↑+2H2O,氧化剂和还原剂物质的量之比为1:5
C. 2H2S+SO2=3S+2H2O中,氧化产物和还原产物物质的量之比为1:1
D. 3S+6KOH=2K2S+K2SO3+3H2O中被氧化和被还原的硫元素物质的量之比为2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】古老但仍然是最有用的制备联氨(N2H4)溶液的方法如下: NaClO+ NH3H2O—— N2H4+ NaCl+ H2O
(1)请配平上述化学方程式,并用单线桥法标出电子转移的方向和数目。__________
(2)NH3H2O在上述反应中显示出来的性质是__________。
A.氧化性 B.还原性
C.酸性 D.碱性
(3)当转移10mol电子时,被氧化的物质的质量为__________。
(4)NH3H2O的电离方程式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】被誉为“矿石熊猫”的香花石,由我国地质学家首次发现,它由前20号元素中的6种组成,分别为X、Y、Z、W、R、T。其中Ⅹ、Y、Z为金属元素,Z的最外层电子数与次外层电子数相等,X、Z位于同族,Y、Z、R、T位于同周期,R最外层电子数是次外层的3倍,T无正价,X与R原子序数之和是W的2倍。下列说法错误的是
A. 原子半径:Y>Z>R>T
B. 气态氢化物的稳定性:W<R<T
C. 最高价氧化物对应的水化物的碱性:X>Z
D. XR2、WR2两种化合物中R的化合价相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com