
【题目】镧系金属元素鈰(Ce)常见有+3、+4两种价态,鈰的合金耐高温,可以用来制造喷气推进器零件。请回答下列问题:
(1)雾霾中含有的污染物NO可以被含Ce4+的溶液吸收,生成![]() 物质的量之比为1∶1,试写出该反应的离子方程式______________________________________________。
物质的量之比为1∶1,试写出该反应的离子方程式______________________________________________。
(2)用电解的方法可将上述吸收液中的![]() 转化为稳定的无毒气体,同时再生Ce4+,其原理如图所示。
转化为稳定的无毒气体,同时再生Ce4+,其原理如图所示。
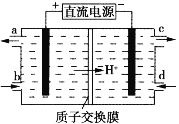
①无毒气体从电解槽的___________(填字母序号)口逸出。
②每生成标准状况下22.4 L无毒气体,同时可再生Ce4+_____________mol。
(3)鈰元素在自然界中主要以氟碳鈰矿形式存在,其主要化学成分为CeFCO3。工业上利用氟碳鈰矿提取CeCl3的一种工艺流程如下:
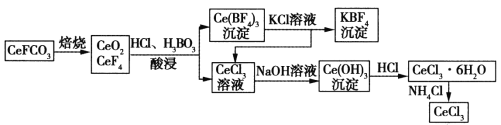
①焙烧过程中发生的主要反应的氧化剂和还原剂的物质的量之比为______________。
②假设参与酸浸反应的CeO2和CeF4的物质的量之比为3∶1,试写出相应的化学方程式________________________________________。
③向Ce(BF4)3中加入KCl溶液的目的是________________________________________。
④常温下,当溶液中的某离子浓度![]() 时,可认为该离子沉淀完全。据此,在生成Ce(OH)3的反应中,加入NaOH溶液至pH至少达到____________时,即可视为Ce3 +已完全沉淀。
时,可认为该离子沉淀完全。据此,在生成Ce(OH)3的反应中,加入NaOH溶液至pH至少达到____________时,即可视为Ce3 +已完全沉淀。![]()
⑤加热CeCl3·6H2O和NH4Cl的固体混合物可得固体无水CeCl3,其中NH4Cl的作用是______________________________________。
【答案】4Ce4+ + 2NO + 3H2O = 4Ce3+ + NO2-+ NO3-+ 6H+c61∶49CeO2 + 3CeF4 + 45HCl + 3H3BO3 = Ce(Br4)3↓+ 11CeCl3 + 6Cl2↑+ 27H2O避免Ce3+以Ce(BF4)3形式沉淀而损失(或将Ce3+全部转化为CeCl3,提高产率)9NH4Cl固体分解产生的HCl可抑制CeCl3的水解
【解析】
(1)雾霾中含有大量的污染物NO,可以被含Ce4+的溶液吸收,生成NO2-、NO3-物质的量之比为1:1,反应的方程式为3H2O+2NO+4Ce4+=4Ce3++NO2-+NO3-+6H+;(2)①电解池中阳极失去电子,则Ce3+在阳极失去电子转化为Ce4+,因此Ce4+从电解槽的a口流出,阴极是NO2-得到电子转化为氮气,则无毒气体从电解槽的c口逸出;②阳极电极反应式为Ce3+-e—=Ce4+,,阴极的电极反应式为2NO2-+8H++6e—=N2↑+4H2O。每生成标准状况下22.4 L无毒气体,同时可再生Ce4+6mol;(3)①根据流程图可知焙烧过程中CeFCO3与氧气反应生成CeO2、CeF4、CO2,反应方程式为4CeFCO3+ O2![]() 3CeO2+ CeF4+4CO2,其中氧化剂O2和还原剂CeFCO3的物质的量之比为1∶4;②假设参与酸浸反应的CeO2和CeF4的物质的量之比为3∶1,根据流程可知反应物还有HCl、H3BO3,生成物有Ce(Br4)3沉淀、CeCl3,根据化合价的变化,因元素Ce由+4价变为+3价,化合价降低,由氧化还原反应原理可知,应有元素化合价升高,则应有Cl2生成,结合质量守恒,则反应的化学方程式为9CeO2 + 3CeF4 + 45HCl + 3H3BO3 = Ce(Br4)3↓+ 11CeCl3 + 6Cl2↑+ 27H2O;③避免Ce3+以Ce(BF4)3形式沉淀而损失或将Ce3+全部转化为CeCl3,提高产率,故向Ce(BF4)3中加入KCl溶液;④常温下,当溶液中c(Ce3 +)
3CeO2+ CeF4+4CO2,其中氧化剂O2和还原剂CeFCO3的物质的量之比为1∶4;②假设参与酸浸反应的CeO2和CeF4的物质的量之比为3∶1,根据流程可知反应物还有HCl、H3BO3,生成物有Ce(Br4)3沉淀、CeCl3,根据化合价的变化,因元素Ce由+4价变为+3价,化合价降低,由氧化还原反应原理可知,应有元素化合价升高,则应有Cl2生成,结合质量守恒,则反应的化学方程式为9CeO2 + 3CeF4 + 45HCl + 3H3BO3 = Ce(Br4)3↓+ 11CeCl3 + 6Cl2↑+ 27H2O;③避免Ce3+以Ce(BF4)3形式沉淀而损失或将Ce3+全部转化为CeCl3,提高产率,故向Ce(BF4)3中加入KCl溶液;④常温下,当溶液中c(Ce3 +)![]() 时,
时,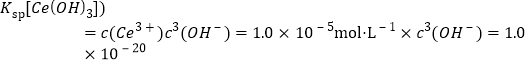 ,则c
,则c![]() ,即pH=9,据此,在生成Ce(OH)3的反应中,加入NaOH溶液至pH至少达到9时,即可视为Ce3 +已完全沉淀;⑤加热CeCl3·6H2O和NH4Cl的固体混合物可得固体无水CeCl3,其中NH4Cl的作用是NH4Cl固体分解产生的HCl可抑制CeCl3的水解。
,即pH=9,据此,在生成Ce(OH)3的反应中,加入NaOH溶液至pH至少达到9时,即可视为Ce3 +已完全沉淀;⑤加热CeCl3·6H2O和NH4Cl的固体混合物可得固体无水CeCl3,其中NH4Cl的作用是NH4Cl固体分解产生的HCl可抑制CeCl3的水解。


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案科目:高中化学 来源: 题型:
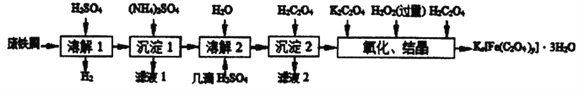
【题目】草酸合铁酸钾晶体Kx[Fe(C2O4)y]·3H2O 是一种光敏材料,见光易分解,下面是一种制备草酸合铁酸钾晶体的实验流程。
已知:(NH4)SO4、FeSO4·7H2O、莫尔盐[(NH4)2SO4·FeSO4·6H2O]的溶解度如表:
温度/℃ | 10 | 20 | 30 | 40 | 50 |
(NH4)SO4/g | 73.0 | 75.4 | 78.0 | 81.0 | 84.5 |
FeSO4·7H2O/g | 40.0 | 48.0 | 60.0 | 73.3 | — |
(NH4)2SO4·FeSO4·6H2O/g | 18.1 | 21.2 | 24.5 | 27.9 | 31.3 |
(1)废铁屑在进行“溶解1”前,得用在5%Na2CO3溶液中加热数分钟,并洗涤干净.Na2CO3溶液的作用是___________________。
(2)“复分解”制备莫尔盐晶体的基本实验步骤是: 蒸发浓缩、_________、过滤、用乙醇洗涤、干燥。用乙醇洗涤的目的是_________ 。
(3)“沉淀2"时得到的FeC2O4·2H2O 沉淀需用水洗涤干净.检验沉淀是否洗涤干净的方法是_____。
(4)“结晶”时应将溶液放在黑暗处等待晶体的析出,这样操作的原因是_________ 。
(5)为测定该晶体中铁的含量,某实验小组做了如下实验:
步骤1: 准确称量5.00g 草酸合铁酸钾晶体,配制成250mL 溶液
步骤2:取所配溶液25.00 mL于锥形瓶中,加稀H2SO4酸化,滴加KMnO4溶液至草酸根恰好全部氧化成二氧化碳,同时,MnO4-被还原成Mn2+。向反应后的溶液中加入一小匙锌粉,加热至黄色刚好消失,过滤,洗涤,将过滤及洗涤所得溶液收集到锥形瓶中,此时,溶液仍呈酸性。
步骤3:用0.010mol/L KMnO4溶液滴定步骤2所得溶液至终点,消耗KMnO4溶液20.02mL,滴定中MnO4-被还原成Mn2+.重复步骤2、步骤3 操作,滴定消耗 0.010mol/LKMnO4溶液19.98mL,实验测得该晶体中铁的质量分数为_____ (写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有常见的A~J物质存在如下转化关系示意图(反应条件已略去),已知通常情况下A为固态金属单质,B、D为气态非金属单质,E为淡黄色固体,F为无色液体,J为红褐色沉淀。请回答下列问题:
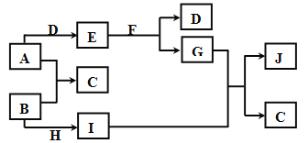
(1)写出下列物质的化学式:H________;D__________。
(2)写出下列转化的化学方程式或离子方程式:
①E+F→D+G的化学方程式:__________________________________;
②G+I→C+J的离子方程式:_________________________________。
(3)若要检验I物质的阳离子所加入的试剂是________________________。实验现象为:_______________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室利用下列装置制氯气,请填空:
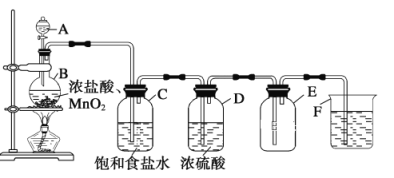
①制氯气的反应原理,请用化学方程式表示:______________。
②饱和食盐水的作用是_________________________________________________。
③浓硫酸的作用是_________________________________________________。
④氢氧化钠的作用是_________________________________________________。
⑤向上排空气法收集氯气的理由是_________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】被誉为“矿石熊猫”的香花石,由我国地质学家首次发现,它由前20号元素中的6种组成,分别为X、Y、Z、W、R、T。其中Ⅹ、Y、Z为金属元素,Z的最外层电子数与次外层电子数相等,X、Z位于同族,Y、Z、R、T位于同周期,R最外层电子数是次外层的3倍,T无正价,X与R原子序数之和是W的2倍。下列说法错误的是
A. 原子半径:Y>Z>R>T
B. 气态氢化物的稳定性:W<R<T
C. 最高价氧化物对应的水化物的碱性:X>Z
D. XR2、WR2两种化合物中R的化合价相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数,下列说法中正确的是( )
A. 足量Fe与1molCl2完全反应,转移电子的数目为3NA
B. 22.4 L 氧气含有的分子数为NA
C. 常温常压下,28 g氮气所含的原子数为2NA
D. 0.1 mol/L的氯化铝溶液中,含有Cl的数目为0.3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知![]() 与足量的10mol/L硫酸液混合微热,产生下列现象:①有红色金属生成②产生刺激性气味的气体③溶液呈现蓝色。据此判断下列说法正确的是
与足量的10mol/L硫酸液混合微热,产生下列现象:①有红色金属生成②产生刺激性气味的气体③溶液呈现蓝色。据此判断下列说法正确的是
A. 反应中硫酸作氧化剂
B. ![]() 中硫元素被氧化
中硫元素被氧化
C. 刺激性气味的气体是氨气
D. 1mol![]() 完全反应转移0.5mol电子
完全反应转移0.5mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将下列物质进行分类:
A.O2和O3 B.![]() C和
C和![]() C C.CH2=CH-CH3和CH2=CH-CH2-CH3
C C.CH2=CH-CH3和CH2=CH-CH2-CH3
D.淀粉和纤维素 E.葡萄糖和蔗糖
F.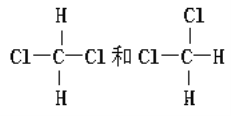 G.
G.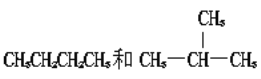
(1) 互为同位素的是 ________________(填编号,下同);
(2) 互为同素异形体的是____________;
(3) 互为同分异构体的是____________;
(4)互为同系物的是____________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向50 mL 18 mol·L-1的H2SO4溶液中加入适量的铜片并加热。充分反应后,被还原的H2SO4的物质的量( )
A. 小于0.45 mol B. 等于0.45 mol
C. 在0.45~0.90 mol之间 D. 大于0.45 mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com