
【题目】将下列物质进行分类:
A.O2和O3 B.![]() C和
C和![]() C C.CH2=CH-CH3和CH2=CH-CH2-CH3
C C.CH2=CH-CH3和CH2=CH-CH2-CH3
D.淀粉和纤维素 E.葡萄糖和蔗糖
F.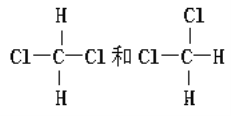 G.
G.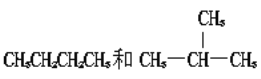
(1) 互为同位素的是 ________________(填编号,下同);
(2) 互为同素异形体的是____________;
(3) 互为同分异构体的是____________;
(4)互为同系物的是____________;
【答案】 B A G C
【解析】(1). 具有相同质子数,不同中子数的同一元素的不同核素互为同位素,![]() C和
C和![]() C具有相同的6个质子,但中子数分别为6.7,选择B;
C具有相同的6个质子,但中子数分别为6.7,选择B;
(2). O2和O3为同素异形体的一种形式,由相同元素构成但组成分子的原子数目不同,选择A;
(3). 同分异构体为化合物具有相同分子式,但具有不同结构。F为同一种物质,因为甲烷的空间结构为正四面体,不存在同分异构体,G中两种物质为同分异构体,选择G。
(4). 同系物指有机物中结构相似,分子式上相差n个CH2的物质。淀粉、纤维素分子式都是(C6H11O5)n,葡萄糖和蔗糖所含官能团不同,结构不相似,故不属于同系物,故选择C。


科目:高中化学 来源: 题型:
【题目】基于CaSO4为载氧体的天然气燃烧是一种新型绿色的燃烧方式,CaSO4作为氧和热量的有效载体,能够高效低能耗地实现CO2的分离和捕获其原理如下图所示:
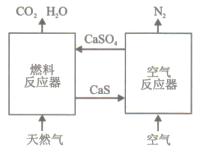
(1)已知在燃料反应器中发生如下反应:
i.4CaSO4(s)+CH4(g)=4CaO(s)+CO2(g)+4SO2(g)+2H2O(g) ΔH1=akJ/mol
ii.CaSO4(s)+CH4(g)=CaS(s)+CO2(g)+2H2O(g) ΔH2=bkJ/mol
ⅲ. CaS(s)+3CaSO4(s)= 4CaO(s)+4SO2(g) ΔH3=ckJ/mol
①燃料反应器中主反应为_________(填“i”“ii”或“ⅲ”)。
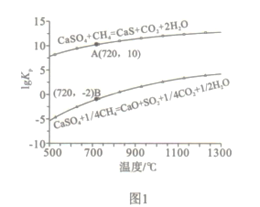
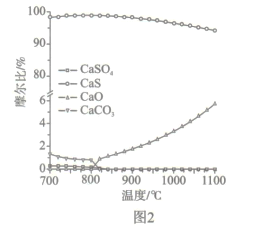
②反应i和ii的平衡常数Kp与温度的关系如图1,则a_______0(填“ >”“ =“或“<” );720℃时反应ⅲ的平衡常数Kp=________。
③下列措施可提高反应ii中甲烷平衡转化率的是_______。
A.增加CaSO4固体的投入量 B.将水蒸气冷凝
C.降温 D.增大甲烷流量
(2)如图2所示,该燃料反应器最佳温度范围为850℃ -900℃之间,从化学反应原理的角度说明原因:_______。
(3)空气反应器中发生的反应为
CaS(s) +2O2(g)=CaSO4(s) ΔH4=dkJ/mol
①根据热化学原理推测该反应为__________反应。
②在天然气燃烧过程中,可循环利用的物质为________。
(4)该原理总反应的热化学方程式为____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镧系金属元素鈰(Ce)常见有+3、+4两种价态,鈰的合金耐高温,可以用来制造喷气推进器零件。请回答下列问题:
(1)雾霾中含有的污染物NO可以被含Ce4+的溶液吸收,生成![]() 物质的量之比为1∶1,试写出该反应的离子方程式______________________________________________。
物质的量之比为1∶1,试写出该反应的离子方程式______________________________________________。
(2)用电解的方法可将上述吸收液中的![]() 转化为稳定的无毒气体,同时再生Ce4+,其原理如图所示。
转化为稳定的无毒气体,同时再生Ce4+,其原理如图所示。
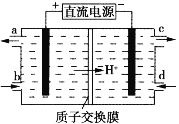
①无毒气体从电解槽的___________(填字母序号)口逸出。
②每生成标准状况下22.4 L无毒气体,同时可再生Ce4+_____________mol。
(3)鈰元素在自然界中主要以氟碳鈰矿形式存在,其主要化学成分为CeFCO3。工业上利用氟碳鈰矿提取CeCl3的一种工艺流程如下:
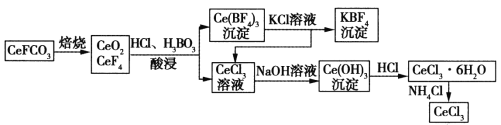
①焙烧过程中发生的主要反应的氧化剂和还原剂的物质的量之比为______________。
②假设参与酸浸反应的CeO2和CeF4的物质的量之比为3∶1,试写出相应的化学方程式________________________________________。
③向Ce(BF4)3中加入KCl溶液的目的是________________________________________。
④常温下,当溶液中的某离子浓度![]() 时,可认为该离子沉淀完全。据此,在生成Ce(OH)3的反应中,加入NaOH溶液至pH至少达到____________时,即可视为Ce3 +已完全沉淀。
时,可认为该离子沉淀完全。据此,在生成Ce(OH)3的反应中,加入NaOH溶液至pH至少达到____________时,即可视为Ce3 +已完全沉淀。![]()
⑤加热CeCl3·6H2O和NH4Cl的固体混合物可得固体无水CeCl3,其中NH4Cl的作用是______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属和非金属被广泛应用于人类生产生活中。
(1)胃液中含有盐酸,胃酸过多的人常有胃疼烧心的感觉,易吐酸水,服用含有小苏打的药品以中和过多的胃酸,其反应的离子方程式:___________________________;
(2)中华透明牙膏摩擦剂SiO2是工业制备晶体硅的原料,工业上制粗硅的反应原理是 __________;(用化学反应方程式表示)。
(3)硅酸钠的水溶液俗称水玻璃,向其中通入过量的CO2,会出现胶状沉淀,其离子方程式是_________;
(4)人体血红蛋白中含有Fe2+,若误食亚硝酸盐,会导致Fe2+转化Fe3+而中毒,服用维生素C可以解毒.对上述的分析正确的是(______)
A.亚硝酸盐是还原剂 B.维生素C是氧化剂
C.维生素C被氧化 D.亚硝酸盐发生氧化反应
(5)化学与生产、生活、社会等密切相关,下列说法正确的是(_______)
A. 二氧化硫具有漂白性,可用来增白纸浆、草帽辫、食品等
B. 酸雨是空气中二氧化碳含量超标引起的
C.工业上合成氨气可用浓氨水和生石灰混合制得
D.蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有吸水性
E.洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一,漂白粉是常用的消毒剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下的定容容器中,当下列哪些物理量不再发生变化时,表明反应:
A(s)+2B(g)![]() C(g)+D(g)已达到平衡状态的是( )
C(g)+D(g)已达到平衡状态的是( )
① 混合气体的压强;② 混合气体的密度;③ B的物质的量浓度;④ 气体总物质的量;⑤ 混合气体的平均相对分子质量;⑥ C、D反应速率的比值
A. ②③⑤ B. ①②③ C. ②③④⑥ D. ①③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,回答下列有关问题:
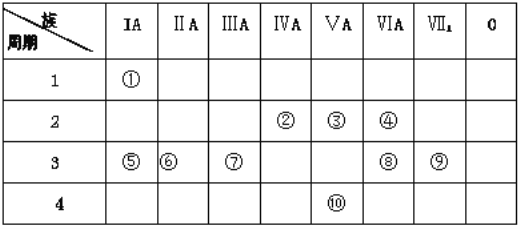
(1)从⑤到⑨元素中非金属性较强的元素是_________(用元素符号表示),这些元素的最高价氧化物对应的水化物中碱性最强的是 _________ (填化学式)。
(2)写出元素④具有强氧化性的氢化物的电子式:_______________。
(3)写出一种由①、③、④三种元素形成的常见离子化合物:________________。
(4)用电子式表示⑥、⑨形成化合物的过程:_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在汽车尾气净化装置里,气体在催化剂表面吸附与解吸作用的过程如图所示:

下列说法不正确的是
A. 该转化过程中有3种元素的化合价发生变化
B. NO 和O2必须在催化剂表面才能反应
C. 该装置将有毒的NO和CO转化为无毒的CO2和N2
D. 该催化转化的总反应方程式为:2NO+O2+4CO![]() 4CO2+N2
4CO2+N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分子式为C2H4O2的结构可能有![]() 和
和![]() 两种,为对其结构进行物理方法鉴定,可用______________或________________。
两种,为对其结构进行物理方法鉴定,可用______________或________________。
(1)若为![]() ,则红外光谱中应该有____个振动吸收;核磁共振氢谱中应该有_____个峰。
,则红外光谱中应该有____个振动吸收;核磁共振氢谱中应该有_____个峰。
(2)若为![]() ,则红外光谱中有______个振动吸收;核磁共振氢谱中应有______个峰。
,则红外光谱中有______个振动吸收;核磁共振氢谱中应有______个峰。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是几种弱电解质的电离平衡常数、难溶电解质的溶度积Ksp(25℃)。
电解质 | 电离方程式 | 电离常数K或Ksp |
CH3COOH | CH3COO | 1.76×10-5 |
H2CO3 | H2CO3 HCO3- | K1=4.31×10-7 K2=5.61×10-11 |
C6H5OH | C6H5OH | 1.1×10-10 |
H3PO4 | H3PO4 H2PO4- HPO42- | K1=7.52×10-3 K2=6.23×10-8 K3=2.20×10-13 |
NH3·H2O | NH3·H2O | 1.76×10-5 |
BaSO4 | BaSO4(s) | 1.07×10-10 |
BaCO3 | BaCO3(s) | 2.58×10-9 |
回答下列问题:
(1)由上表分析,若①CH3COOH,②HCO3-,③C6H5OH,④H2PO4-均可看做酸,则它们酸性由强到弱的顺序为_____________(填编号)。
(2)写出C6H5OH与Na3PO4反应的离子方程式_______________________________。
(3)25℃时,将等体积等浓度的醋酸和氨水混合,混合液中:c(CH3COO-)____c(NH4+)(填“>”、“=”或“<”)。
(4)25℃时,向10mL0.01mol/L苯酚溶液中滴加VmL0.01mol/L氨水,混合液中粒子浓度关系正确的是__________(填字母序号)。
A.若混合液pH>7,则V≥10
B.若混合液 pH<7,则c(NH4+)>c(C6H5O-)>c(H+)>c(OH-)
C.V=10时,混合液中水的电离程度小于10mL0.01mol/L苯酚溶液中水的电离程度
D.V= 5时,2c(NH3·H2O)+2c(NH4+)=c(C6H5O-)+c(C6H5OH)
(5)水解反应是典型的可逆反应,水解反应的化学平衡常数称为水解常数(用Kb表示),类比化学平衡常数的定义,请写出Na2CO3第一步水解反应的水解常数的表达式:____________。
(6)I,如图所示,有T1、T2两种温度下两条BaSO4在水中的沉淀溶解平衡曲线,回答下列问题:

①T1______T2(填“>”、“=”或‘‘<”),T2温度时 Ksp(BaSO4)=_______________;
②讨论T1温度时BaSO4的沉淀溶解平衡曲线,下列说法正确的是______(填字母序号)。
A.加入Na2SO4可使溶液由a点变为b点
B.在T1曲线上方区域(不含曲线)任意一点时,均有BaSO4沉淀生成
C.蒸发溶剂可能使溶液由d点变为曲线上a,b之间的某一点(不含a,b)
D.升温可使溶液由b点变为d点
II.现有0.2mol的BaSO4沉淀,每次用1L饱和Na2CO3溶液(浓度为1.7mol/L)处理。若使BaSO4中的SO42-全部转化到溶液中,需要反复处理_____次。[提示:BaSO4(s)+CO32-(aq)![]() BaCO3(s)+SO42-(aq)]
BaCO3(s)+SO42-(aq)]
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com