
【题目】金属和非金属被广泛应用于人类生产生活中。
(1)胃液中含有盐酸,胃酸过多的人常有胃疼烧心的感觉,易吐酸水,服用含有小苏打的药品以中和过多的胃酸,其反应的离子方程式:___________________________;
(2)中华透明牙膏摩擦剂SiO2是工业制备晶体硅的原料,工业上制粗硅的反应原理是 __________;(用化学反应方程式表示)。
(3)硅酸钠的水溶液俗称水玻璃,向其中通入过量的CO2,会出现胶状沉淀,其离子方程式是_________;
(4)人体血红蛋白中含有Fe2+,若误食亚硝酸盐,会导致Fe2+转化Fe3+而中毒,服用维生素C可以解毒.对上述的分析正确的是(______)
A.亚硝酸盐是还原剂 B.维生素C是氧化剂
C.维生素C被氧化 D.亚硝酸盐发生氧化反应
(5)化学与生产、生活、社会等密切相关,下列说法正确的是(_______)
A. 二氧化硫具有漂白性,可用来增白纸浆、草帽辫、食品等
B. 酸雨是空气中二氧化碳含量超标引起的
C.工业上合成氨气可用浓氨水和生石灰混合制得
D.蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有吸水性
E.洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一,漂白粉是常用的消毒剂
【答案】H++HCO3-=H2O+CO2↑ SiO2+2C ![]() Si+2CO↑ SiO32-+2CO2+2H2O=H2SiO3↓+2HCO3- C E
Si+2CO↑ SiO32-+2CO2+2H2O=H2SiO3↓+2HCO3- C E
【解析】
化学与生产、生活、社会密切相关,运用中学化学知识分析解决有关问题。
(1)小苏打即碳酸氢钠,可治疗胃酸过多,反应的离子方程式H++HCO3-=H2O+CO2↑;
(2)工业上用SiO2制粗硅的化学反应方程式是SiO2+2C ![]() Si+2CO↑;
Si+2CO↑;
(3)碳酸的酸性较硅酸强,硅酸钠溶液中通入过量CO2的离子方程式是SiO32-+2CO2+2H2O=H2SiO3↓+2HCO3-;
(4)亚硝酸盐能将Fe2+变成Fe3+使人中毒,亚硝酸盐是氧化剂,发生还原反应;维生素C能将Fe3+变成Fe2+而解毒,维生素C是还原剂,在反应中被氧化,选C。
(5)A. 二氧化硫有毒,不能用于漂白食品;
B. 酸雨是空气中二氧化硫或氮的氧化物的含量超标引起的;
C.工业上用氮气和氢气合成氨气,实验室可用浓氨水和生石灰混合制氨气;
D.浓硫酸使蔗糖变黑,说明浓硫酸具有脱水性;
E.漂白粉中的次氯酸钙能转变成次氯酸,次氯酸用于消毒杀菌,漂白粉是常用的消毒剂。
选E。


科目:高中化学 来源: 题型:
【题目】短周期主族元素R、X、Y、Z 在周期表中的相对位置如图所示。已知: Y的最高价氧化物对应的水化物既能与强碱反应,又能与强酸反应。下列说法不正确的是
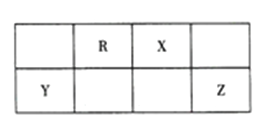
A. 简单气态氢化物的热稳定性: R<X
B. Y、Z的简单离子在同一溶液中能大量共存
C. 工业上,采用电解法冶炼单质Y
D. RZ2是含极性键的共价化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室利用下列装置制氯气,请填空:
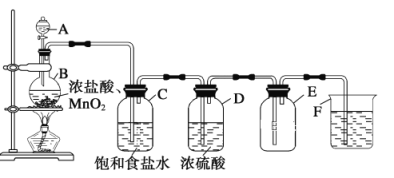
①制氯气的反应原理,请用化学方程式表示:______________。
②饱和食盐水的作用是_________________________________________________。
③浓硫酸的作用是_________________________________________________。
④氢氧化钠的作用是_________________________________________________。
⑤向上排空气法收集氯气的理由是_________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数,下列说法中正确的是( )
A. 足量Fe与1molCl2完全反应,转移电子的数目为3NA
B. 22.4 L 氧气含有的分子数为NA
C. 常温常压下,28 g氮气所含的原子数为2NA
D. 0.1 mol/L的氯化铝溶液中,含有Cl的数目为0.3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知![]() 与足量的10mol/L硫酸液混合微热,产生下列现象:①有红色金属生成②产生刺激性气味的气体③溶液呈现蓝色。据此判断下列说法正确的是
与足量的10mol/L硫酸液混合微热,产生下列现象:①有红色金属生成②产生刺激性气味的气体③溶液呈现蓝色。据此判断下列说法正确的是
A. 反应中硫酸作氧化剂
B. ![]() 中硫元素被氧化
中硫元素被氧化
C. 刺激性气味的气体是氨气
D. 1mol![]() 完全反应转移0.5mol电子
完全反应转移0.5mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组欲进行如下的实验探究金属与浓硫酸反应。试回答下列问题:
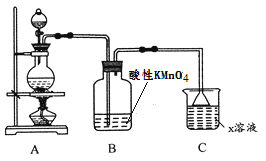
(1)利用上图装置研究铜与浓硫酸反应,反应的化学方程式为_____________________。
(2)C装置的作用___________________。
(3)将上述实验中的铜改为铁,在常温下进行,无明显现象,其原因是_______________。在加热条件下,实验的后阶段可观察到倒立的漏斗边沿有气体冒出,该气体可能为_______。
(4)利用黄铜矿冶炼铜产生的炉渣(含Fe2O3、FeO、Al2O3及不溶于强酸的SiO2)可制备Fe2O3。①用稀盐酸浸取炉渣,过滤;②滤液先氧化,再加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得Fe2O3。据以上信息回答下列问题:
a.除去Al3+的离子方程式是______________________________。
b.步骤②中滤液氧化的目的是_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将下列物质进行分类:
A.O2和O3 B.![]() C和
C和![]() C C.CH2=CH-CH3和CH2=CH-CH2-CH3
C C.CH2=CH-CH3和CH2=CH-CH2-CH3
D.淀粉和纤维素 E.葡萄糖和蔗糖
F.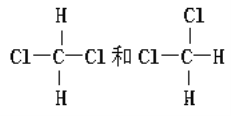 G.
G.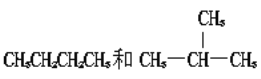
(1) 互为同位素的是 ________________(填编号,下同);
(2) 互为同素异形体的是____________;
(3) 互为同分异构体的是____________;
(4)互为同系物的是____________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼(B)、铝(Al)、镓(Ga)均属于硼族元素(第ⅢA族),它们的化合物或单质都有重要用途。回答下列问题:
(1)写出基态镓原子的电子排布式____________。
(2)已知:无水氯化铝在178℃升华,它的蒸气是缔合的双分于(Al2Cl6),更高温度下Al2Cl6则离解生成A1Cl3单分子。
①固体氯化铝的晶体类型是______________;
②写出Al2Cl6分子的结构式_______________;
③单分子A1Cl3的立体构型是__________,缔合双分子Al2Cl6中Al原子的轨道杂化类型是_______。
(3)晶体硼的结构单元是正二十面体,每个单元中有12个硼原子(如图),若其中有两个原子为10B,其余为11B,则该结构单元有____________种不同的结构类型。

(4)金属铝属立方晶系,其晶胞边长为405 pm,密度是2.70g·cm3,计算确定其晶胞的类型(简单、体心或面心立方)________________;晶胞中距离最近的铝原子可看作是接触的,列式计算铝的原子半径r(A1)=______________pm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气是一种理想的“绿色能源”,利用氢能需要选择合适的储氢材料。目前正在研究和使用的储氢材料有镁系合金、稀土系合金等。
(1)已知,Mg(s) +H2(g)==MgH2(s) △H=-74.5kJ/mol
Mg2Ni(s) + 2H2(g)==Mg2NiH4(s) △H=-64.4kJ/mol
MgNi(s)+ 2MgH2(s)==2Mg(s)+ Mg2NiH4(s) △H=____kJ/mol。
(2)储氢材料Mg(AlH4)2在110~200℃的反应为:Mg(AlH4)2==MgH2+2Al+3H2↑。反应中每转移3mol电子时,产生的H2在标准状况下的体积为_____________L。
(3)镧镍合金在一定条件下可吸收氢气形成氢化物:LaNi5(s)+3H2(g) ![]() LaNi5H6(s) △H<0,欲使LaNi5H6(s)释放出气态氢,根据平衡移动原理,可改变的条件是_________(填字母编号)。
LaNi5H6(s) △H<0,欲使LaNi5H6(s)释放出气态氢,根据平衡移动原理,可改变的条件是_________(填字母编号)。
a.增加LaNi5H6(s)的量 b.升高温度 c.减小压强 d.使用催化剂
(4)储氢还可借助有机物,如利用环己烷和苯之间的可逆反应来实现脱氢和加氢:![]()
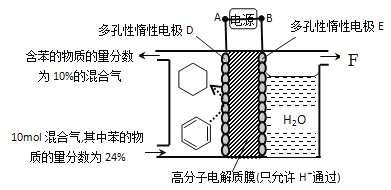
①某温度下,向恒容密闭容器中加入环己烷,起始浓度为amol·L-1,平衡时苯的浓度为b mol·L-1,该反应的平衡常数K=_____________(用含a、b的代数式表示)。
②一定条件下,下图装置可实现有机物的电化学储氢(忽略其它有机物)。A是电源的__________极(填“正”或“负”);电解过程中产生的气体F为________(填化学式):电极D上发生的电极反应为____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com