
【题目】实验室利用下列装置制氯气,请填空:
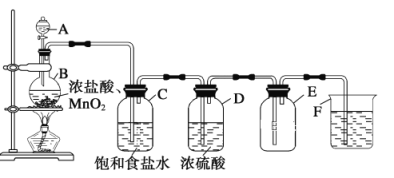
①制氯气的反应原理,请用化学方程式表示:______________。
②饱和食盐水的作用是_________________________________________________。
③浓硫酸的作用是_________________________________________________。
④氢氧化钠的作用是_________________________________________________。
⑤向上排空气法收集氯气的理由是_________________________________________________。
【答案】MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O 除去HCl 干燥氯气 (或除去水蒸气) _吸收氯气,防止污染空气 氯气比空气重
MnCl2+Cl2↑+2H2O 除去HCl 干燥氯气 (或除去水蒸气) _吸收氯气,防止污染空气 氯气比空气重
【解析】
①实验室在加热时用二氧化锰和浓盐酸反应制取氯气;
②饱和食盐水是为了除去Cl2中的HCl;
③浓硫酸的作用是干燥Cl2;
④为了防止Cl2污染空气。用氢氧化钠进行尾气的回收;
⑤依据Cl2和空气密度大小,分析收集方法。
①实验室在加热时用二氧化锰和浓盐酸反应制取氯气,反应的化学方程式为:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O;
MnCl2+Cl2↑+2H2O;
本题答案为:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O。
MnCl2+Cl2↑+2H2O。
②饱和食盐水是为了除去Cl2中的HCl;
本题答案为:除去HCl。
③浓硫酸的作用是干燥Cl2;
本题答案为:干燥氯气 (或除去水蒸气)。
④为了防止Cl2污染空气。用氢氧化钠进行尾气的回收;
本题答案为:吸收氯气,防止污染空气。
⑤依据Cl2的密度比空气密度大,所以应采用向上排空气法收集氯气;
本题答案为:氯气比空气重。


 红果子三级测试卷系列答案
红果子三级测试卷系列答案 课堂练加测系列答案
课堂练加测系列答案科目:高中化学 来源: 题型:
【题目】(1)在标准状况下①6.72L CH4 ②3.01×1023个HCl分子③ 13.6g H2S ④0.2mol NH3, 下列对这四种气体的关系从大到小表达正确的是_____
a.体积②>③>①>④ b.密度②>③>④>①
c.质量②>③>①>④ d.氢原子个数①>③>④>②
(2)在标准状况下,CO和CO2的混合气体共39.2 L,质量为61 g。则其中CO2为________mol, CO占总体积的______(保留一位小数),混合气体的摩尔质量为_______(保留一位小数)。
(3)某混合气体中各气体的质量分数为:O232%,N228%,CO222%,CH416%,H22%,则此混合气体的平均摩尔质量为______(保留两位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】基于CaSO4为载氧体的天然气燃烧是一种新型绿色的燃烧方式,CaSO4作为氧和热量的有效载体,能够高效低能耗地实现CO2的分离和捕获其原理如下图所示:
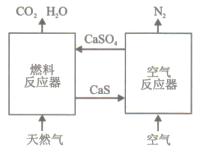
(1)已知在燃料反应器中发生如下反应:
i.4CaSO4(s)+CH4(g)=4CaO(s)+CO2(g)+4SO2(g)+2H2O(g) ΔH1=akJ/mol
ii.CaSO4(s)+CH4(g)=CaS(s)+CO2(g)+2H2O(g) ΔH2=bkJ/mol
ⅲ. CaS(s)+3CaSO4(s)= 4CaO(s)+4SO2(g) ΔH3=ckJ/mol
①燃料反应器中主反应为_________(填“i”“ii”或“ⅲ”)。
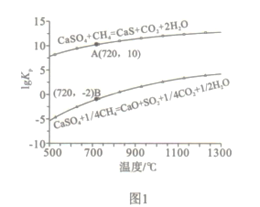
②反应i和ii的平衡常数Kp与温度的关系如图1,则a_______0(填“ >”“ =“或“<” );720℃时反应ⅲ的平衡常数Kp=________。
③下列措施可提高反应ii中甲烷平衡转化率的是_______。
A.增加CaSO4固体的投入量 B.将水蒸气冷凝
C.降温 D.增大甲烷流量
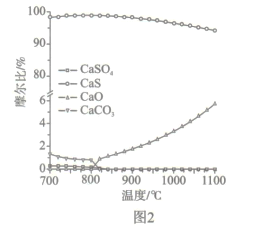
(2)如图2所示,该燃料反应器最佳温度范围为850℃ -900℃之间,从化学反应原理的角度说明原因:_______。
(3)空气反应器中发生的反应为
CaS(s) +2O2(g)=CaSO4(s) ΔH4=dkJ/mol
①根据热化学原理推测该反应为__________反应。
②在天然气燃烧过程中,可循环利用的物质为________。
(4)该原理总反应的热化学方程式为____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将共0.4molMg、Al的混合物用盐酸完全溶解,放出标准状况下11.2L气体,然后再滴2mol/LNaOH溶液,请回答:
(1)求该混合物中Mg、Al的物质的量之比______________
(2)若该Mg、Al的混合物与盐酸恰好完全反应,在滴加NaOH溶液过程中,欲使Mg2+、Al3+刚好沉淀完全,则滴入NaOH溶液的体积V=________________ mL。
(3)若该Mg、Al混合物溶于400mL 3mol/L盐酸后,滴入NaOH溶液,使所得沉淀中无Al(OH)3,则滴入NaOH溶液的体积最少为 _____________________ mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组中的离子,能在溶液中大量共存的是
A. K+、H+、SO![]() 、OH- B. Na+、Ca2+、CO
、OH- B. Na+、Ca2+、CO![]() 、NO
、NO![]()
C. Na+、H+、Cl-、CO![]() D. Na+、Cu2+、Cl-、SO
D. Na+、Cu2+、Cl-、SO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向50 mL 18 mol·L-1的H2SO4溶液中加入适量的铜片并加热。充分反应后,被还原的H2SO4的物质的量( )
A. 小于0.45 mol B. 等于0.45 mol
C. 在0.45~0.90 mol之间 D. 大于0.45 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镧系金属元素鈰(Ce)常见有+3、+4两种价态,鈰的合金耐高温,可以用来制造喷气推进器零件。请回答下列问题:
(1)雾霾中含有的污染物NO可以被含Ce4+的溶液吸收,生成![]() 物质的量之比为1∶1,试写出该反应的离子方程式______________________________________________。
物质的量之比为1∶1,试写出该反应的离子方程式______________________________________________。
(2)用电解的方法可将上述吸收液中的![]() 转化为稳定的无毒气体,同时再生Ce4+,其原理如图所示。
转化为稳定的无毒气体,同时再生Ce4+,其原理如图所示。
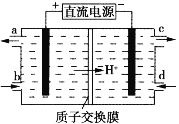
①无毒气体从电解槽的___________(填字母序号)口逸出。
②每生成标准状况下22.4 L无毒气体,同时可再生Ce4+_____________mol。
(3)鈰元素在自然界中主要以氟碳鈰矿形式存在,其主要化学成分为CeFCO3。工业上利用氟碳鈰矿提取CeCl3的一种工艺流程如下:
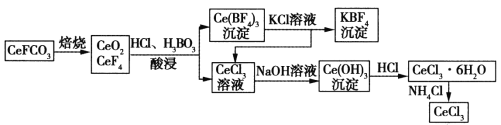
①焙烧过程中发生的主要反应的氧化剂和还原剂的物质的量之比为______________。
②假设参与酸浸反应的CeO2和CeF4的物质的量之比为3∶1,试写出相应的化学方程式________________________________________。
③向Ce(BF4)3中加入KCl溶液的目的是________________________________________。
④常温下,当溶液中的某离子浓度![]() 时,可认为该离子沉淀完全。据此,在生成Ce(OH)3的反应中,加入NaOH溶液至pH至少达到____________时,即可视为Ce3 +已完全沉淀。
时,可认为该离子沉淀完全。据此,在生成Ce(OH)3的反应中,加入NaOH溶液至pH至少达到____________时,即可视为Ce3 +已完全沉淀。![]()
⑤加热CeCl3·6H2O和NH4Cl的固体混合物可得固体无水CeCl3,其中NH4Cl的作用是______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属和非金属被广泛应用于人类生产生活中。
(1)胃液中含有盐酸,胃酸过多的人常有胃疼烧心的感觉,易吐酸水,服用含有小苏打的药品以中和过多的胃酸,其反应的离子方程式:___________________________;
(2)中华透明牙膏摩擦剂SiO2是工业制备晶体硅的原料,工业上制粗硅的反应原理是 __________;(用化学反应方程式表示)。
(3)硅酸钠的水溶液俗称水玻璃,向其中通入过量的CO2,会出现胶状沉淀,其离子方程式是_________;
(4)人体血红蛋白中含有Fe2+,若误食亚硝酸盐,会导致Fe2+转化Fe3+而中毒,服用维生素C可以解毒.对上述的分析正确的是(______)
A.亚硝酸盐是还原剂 B.维生素C是氧化剂
C.维生素C被氧化 D.亚硝酸盐发生氧化反应
(5)化学与生产、生活、社会等密切相关,下列说法正确的是(_______)
A. 二氧化硫具有漂白性,可用来增白纸浆、草帽辫、食品等
B. 酸雨是空气中二氧化碳含量超标引起的
C.工业上合成氨气可用浓氨水和生石灰混合制得
D.蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有吸水性
E.洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一,漂白粉是常用的消毒剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分子式为C2H4O2的结构可能有![]() 和
和![]() 两种,为对其结构进行物理方法鉴定,可用______________或________________。
两种,为对其结构进行物理方法鉴定,可用______________或________________。
(1)若为![]() ,则红外光谱中应该有____个振动吸收;核磁共振氢谱中应该有_____个峰。
,则红外光谱中应该有____个振动吸收;核磁共振氢谱中应该有_____个峰。
(2)若为![]() ,则红外光谱中有______个振动吸收;核磁共振氢谱中应有______个峰。
,则红外光谱中有______个振动吸收;核磁共振氢谱中应有______个峰。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com